第一章 燃燒化學
第一節 燃燒現象
燃燒之簡單定義為帶有熱與光之氧化反應,通常反應速度在高速進行時其反應熱大且有發光現象時稱為燃燒。氧化反應中雖然產生熱,但無發光時區分為緩慢燃燒。在常態下能被氧化之物可成為可燃物,但需要活化能大,氧化熱小之物因不易維持燃燒所以稱為難燃物,不過難燃物在適當條件下如在高溫或氧氣中時燃燒變為快速,此種條件下難燃物變成易燃物,可見所謂易燃,可燃或難燃指常態下之條件而言。
燃燒常以瓦斯狀進行,如液態之重油、固態之木材、煤炭等在燃燒之前需經過蒸發或受熱分解產生可燃性多種瓦斯,與空氣形成易燃性混合氣,有火源時則起火燃燒。能使某物質起燃除了可燃物與氧氣外尚需供應活化能始可。點火有多種方式,如加熱、火焰、電氣火花、磨擦熱、反應熱及壓縮熱等。起燃時因有活化能,可燃物之分子被活化後開始與氧氣反應。值得注意者只用點火手續燃燒仍無法進行,因可燃物在局部被點燃時產生之燃燒熱以熱傳導方式傳熱至周圍之可燃物。受熱之部分溫度達到著火點時燃燒得以繼續或燃燒擴大。但傳熱之熱量被奪去或被冷卻至原有熱量以下時燃燒將會停止。
如前所述,某物質在空氣中或氧氣中受激烈之氧化反應產生熱與光之現象稱為燃燒。起燃時需有可燃物、充分之空氣及起燃所需之熱源。此等三要素則稱為燃燒三角(Fire triangle)。起燃後有熱之產生並進行可燃物之熱分解(Pyrolysis),因能繼續供應易燃性瓦斯。所以燃燒得以維持不斷。維持燃燒尚需有自由基(Free radicals)之存在,而構成燃燒四面體(Fire tetrahedron)。可燃物中如火柴、火箭原料等本身含有氧來源之物在周圍無空氣之條件下仍可燃燒或爆炸。
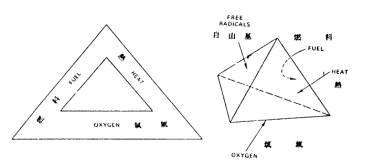
圖1 燃燒三角及燃燒四面體
一、燃燒反應
如前所述燃燒屬於可燃性物質與氧化合之氧化反應。以碳氫化合物為例,燃燒後各成為
CO2及H2O。
CH4+2O2→CO2 + 2H2O
C3H8 + 5O2→3CO2 + 4H2O
2C4H10 + 13O2→8CO2 + 10H2O
CmHn + (m+0.25n)O2→mCO2+0.5nH2O
上列各式僅有最初及最後產物,其實中間有極為複雜之反應過程,通常燃燒反應被認為以連鎖反應之形態進行。以氫氣之燃燒為例其過程如下:
2H2+O2→2H2O…………………..(1)
上式極為簡單,實際上有H2→2H,O2→2O,H2O→OH+H等各分子互相碰撞而解離為原子狀態並生成游離基(radical)。此物則為促進連鎖反應之媒介物。氫氣燃燒之第一階段為H2分子解離為H原子(H2→2H),再與穩定狀態之O2結合為HO2,因此物極不穩定,易與未反應之H2分子反應而依次分解如下:
H+O2→HO2……………………….(2)
HO2 + H2→H2O2 + H………………(3)
HO2 + H2→H2O + OH…..…………(4)
2H2O2→2H2O + O2………………..(5)
上式中之OH與未反應之氫反應產生H2O,同時游離出H以連鎖反應之方式進行。
OH + H2→H2O + H………………..(6)
氫在完全燃燒後所餘者有穩定之H2O、少量H2及O2,而無剩餘之游離H及OH。
H + OH→H2O……………………(7)
H + H→H2 ………………………(8)
依上述反應過程可知燃燒中所謂游離基(radical)逐漸減少時連鎖反應隨之終止。
二、燃料
能當作熱源之物稱為燃料,對人類而言其重要性屬於文明生活之基本條件之一。人類使用燃料之歷史由來已久,經長期之演變由古時唯一燃料之固體燃料木材開始,之後使用煤炭、再發現石油系液體燃料並發展至污染性較低之氣體燃料甚至應用核能燃料。
三、燃燒之形態
可燃物之燃燒因固體、液體、氣體之不同燃燒之形態則有差異。固體燃料被加熱時,由熱分解生成易燃性瓦斯而與空氣形成混合氣。液體燃料則需產生蒸氣後與空氣形成混合氣、氣體燃料直接與空氣混合則可。起燃之難易示於圖2。
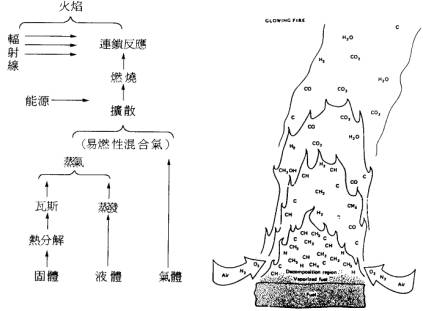
圖2 固體、液體氣體之燃燒及有機物在燃燒時之火焰
燃燒有多種方式,可分為下列燃燒形態:
(1)擴散燃燒
可燃性瓦斯分子與空氣分子互相擴散混合起燃之現象。如氫氣、甲烷、丙烷等可燃性 瓦斯由噴嘴流出於空氣中被點燃時則屬之。
(2)蒸發燃燒
醇類、醚類等引火性液體由蒸發產生之蒸氣引火產生火焰,起燃後自液體表面繼續蒸發 而維持燃燒之現象。
(3)分解燃燒
固體可燃物如木材、煤炭、纖維等在空氣中被加熱時先失去水分。再起熱分解而產生可燃性瓦斯,起燃後由火焰維持其燃燒。
(4)表面燃燒
如木炭、焦炭等物由熱分解之結果產生無定形炭化物,而在固體表面與空氣接觸之部分 形成燃燒帶(Zone)。燃燒常維持在表面。鋁箔、鎂箔等燃燒可歸納在此類。表面燃燒通常不帶有明顯之火焰,有時因不完全燃燒之故或有產生一氧化碳形成火焰之可能。
(5)自身燃燒(Self burning)
火炸藥在分子內含有氧而不需由空氣中之氧維持其燃燒,此系之反應速度快,燃燒速度迅速以致有爆炸性燃燒發生。
四、引火點與發火點(Flash point and Auto ignition
point)
接近於可燃性液體或固體之表面置一小火焰,將可燃性物緩慢加熱,此時自可燃性物產生之蒸氣(瓦斯)由小火焰能引燃之最低溫度稱為引火點。亦可認為可燃性瓦斯之濃度達到燃燒下限時之溫度。引火點之測定ASTM,NFPA,JIS等均採用Pensky-Mertens,Cleveland(引火點80℃以上)及Tagliabue(引火點80℃以下)。此等裝置參考消防化學(II)。
發火點指可燃物受熱時不藉火焰或電器火花引火也能自燃之溫度,如容器中置有可燃物用加熱包(Heating mantle)緩慢加熱至被加熱物由本身起燃所需最低溫度。發火點與著火點屬同意語,以化學立場稱為發火,以機械觀點則用著火。
瓦斯在燃燒時如氫氣或一氧化碳與氧氣之化學反應屬於最簡單之反應例。多種化合物之燃燒過程極為複雜,為進行燃燒該物質產生之可燃瓦斯需達到燃燒下限及在一定溫度下始可。一旦燃燒開始產生之熱將周圍之瓦斯及空氣加熱至能繼續維持反應時才有火焰存在。液體及固體易與氧氣反應者其發火溫度則低,對固體燃料而言受熱時不易產生易燃揮發性成分者只有表面燃燒、所以燃燒速度慢。表1為常見燃料之發火溫度。
|
燃燒名稱 |
空氣中之發火點 |
氧氣中之發火點 |
燃燒名稱 |
空氣中之發火點 |
氧氣中之發火點 |
燃燒名稱 |
空氣中之發火點 |
|
氫氣 |
609℃ |
588℃ |
苯 |
580℃ |
566℃ |
無煙炭 |
500℃ |
|
甲烷 |
572 |
560 |
二硫化碳 |
120 |
107 |
焦炭 |
420~620 |
|
乙烷 |
632 |
556 |
正-戍烷 |
290 |
258 |
瀝青炭 |
380~420 |
|
乙烯 |
472 |
450 |
甲苯 |
552 |
516 |
木炭 |
300 |
|
丙烷 |
490 |
485 |
92汽油 |
430 |
415 |
|
|
|
丁烷 |
510 |
|
Cetan#60柴油 |
247 |
242 |
|
|
|
乙炔 |
490 |
|
|
|
|
|
|
表1氣、液、固體燃料之發火溫度
五、自然發火與混合發火
(1)自然發火
某種物質在空氣中常溫常壓下由化學變化產生反應熱經蓄熱以致溫度上升至發火點而自燃之現象。在空氣中立刻發火或在水分、濕氣存在下緩慢或激烈發火者稱為準自然發火性物。
(2)影響自然發火之各因素
在空氣中常溫常壓下且無火源而物質本身能自燃時應有必備之條件:
1蓄熱:
自然發火之起因來自於氧化、分解、聚合、吸附、發酵等產生之熱蓄積引起反應系內部溫度之上升,因此蓄熱則為重要因素之一。當反應系之熱平衡呈現散熱大於蓄熱時則可避免自然發火。
a.熱傳導度:氣體、液體、固體中氣體之熱傳導度最小,依次為液體及非金屬固體、金屬則最大。依此觀點氣體最容易燃燒,金屬則較難。對物質之構造而言,粉狀物、纖維狀、多孔質者在結構內部產生之氧化熱較難傳導至表面,類似保溫之效果所以內部溫度容易上升。
b.空氣之影響:通風良好之處能自發熱體之外部加以冷卻,因為不易蓄熱,所以自然發火之可能性較低。
2熱之產生速度:
熱之產生速度與蓄熱相同對自然發火有重大關係。發熱量與反應速度之乘積則為熱之產生速度,設單位量之發熱量為Q時反應熱之產生速度為
Q.Ae-E/RT
A:頻度係數cm/s;E:活化能cal/mol.;R:氣體定數cal/mol.;T:絕對溫度。K
由上式可知發熱量雖大,倘反應速度小時此物質之熱產生速度則小。
3發熱量、表面積、溫度、水分等因素:
發熱量大之物質較易自然發火。發熱體屬於易傳熱者因容易散熱而不易蓄熱。當溶劑類滲透在多孔質或纖維等表面積大之物體時因有充分之氧氣供應,且周圍有熱傳導不良之空氣所包圍,結果處於防止散熱之狀態。溫度與反應速率有密切關係,溫度愈高,反應愈快,危險性則增加。為緩和反應之進行採降溫措施則可。水分過多不易自燃,但微量水分之存在則對自然發火有催化作用。
自然發火案例:
自然發火可分為分解熱、氧化熱、吸附熱、聚合熱及發酵熱。
a.由分解熱起燃之物
此系有硝化棉,塞璐珞等物。以硝化棉為例,在空氣中由水解及熱分解生成熱,由 反應熱之蓄積而起燃。起初硝化棉受微量水分引起水解產生硝酸,在此反應中H+及OH-有促進分解之功能。當硝化棉之NO2斷裂為NO2→NO+[O]時氧化繼續進行以致起燃。
b.由氧化熱起燃之物
油脂類可分為乾性油、半乾性油及非乾性油。如棉花、破布、木屑等表面積極大之物體上附著乾性油時因與空氣之接觸面大所以易受氧化而由氧化熱之蓄積引起自燃。油脂類受氧化之難易可用碘價(Iodine value)表示,碘價指100g油脂能吸收之碘克數,油脂之碘價在100以下時稱為非乾性油;100~130者為半乾性油;130以上則屬乾性油。日常生活中屬於乾性油而與自然發火有關者有桐油,亞麻仁油,菜子油等。乾性油之反應過程可用下式表示:
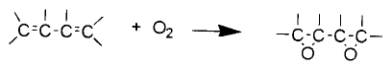
動植物油在燃燒時煙少,燃燒速度慢,輻射熱小,有很多特異點。
c.由吸附熱起燃之物
活性碳於製造後粒子表面之活性大,在空氣中吸附各種成分而發熱,此時吸附之氧氣繼續促進氧化,由吸附熱及氧化熱形成蓄熱條件,散熱不良時溫度則上升。
d.由聚合熱起燃之物
工業界常用醋酸乙烯CH2 = CH(OCOCH3),丙烯晴CH2 = CH-CN,液態氫化氰
H-CN,苯乙烯C6H5-CH = CH2等單體合成多種聚合物。在合成過程中聚合熱失控時會引起火災或爆炸。
準自然發火性物
在空氣中發火點低或與空氣接觸時能自燃之物,因大部分與水接觸時能發火,有時亦稱為禁水性物。如鋰Li,鈉Na,鉀K,鈣Ca,鎂Mg等金屬外尚有40餘種(參考消防化學II)
混合發火性物
兩種以上之物質經混合或接觸後由化學反應發熱而起燃之組合,依反應狀態可分為:
(1)混合後立刻燃燒或爆炸。
(2)混合後立刻產生可燃性氣體或毒氣。
(3)混合後經過一段時間才開始反應。
需注意某些化合物單獨存在時為非燃性或穩定性高之物,當混合後則成為混合發火性物。通常一方係氧化性物而另一方屬於可燃性物。如第(3)項往往在無防備下發生。混合發火性物之組合眾多。可參考NFPA Hazardous Materials 49,
491M,表2為其中之一小部分。其他與化學火災有關物質之起火原因及氧化性物與還原性物之組合能起燃或爆炸之部分可參考表3及表4
表2 混合後能發火或爆炸之組合
|
物質名稱 |
避免混合之物質 |
|
鹵素(Cl、Br、I) |
氨氣、氫氣、紅磷、鹼金屬、銅、鋅、鋁等金屬 |
|
強酸類及酸無水物 |
氨氣、不飽和油脂、可燃性有機物 |
|
過氧化物(如Na2O2) |
鋁或鎂粉、碳化鈣、乙醚、硫黃,可燃性有機物 |
|
氯酸鹽 |
硫黃、金屬粉、氨氣、強酸 |
|
過氯酸鹽 |
硝酸銀、氯化錫 |
|
漂白粉 |
硝酸、乙炔 |
表3與化學火災有關物質及起火原因
|
由氧化而易起燃之物 |
黃磷 活性碳 賽璐珞 塗料渣 聚丙烯纖維 聚乙烯氯聚合體 環氧樹脂 |
在空氣中受氧化而發熱 由吸附熱而發熱 長時間在空氣中起分解而發熱 長時間在空氣中起分解而發熱 製造後尚有餘熱而氧化反應 製造中之異常反應而起火 製造中之異常反應而起火 |
|
由濕氣或加水時起燃之物 |
金屬鈉 金屬粉 硫化鈉 磷化鋁 磷化鈣 高濃度漂白粉 鹼土類金屬過氧化物 |
與水分接觸時起火 與水分接觸時起火 與水分接觸時發熱 與水分接觸時發熱 與水分接觸時發熱 與水分接觸或加其他藥品時發熱 與水分接觸或加其他藥品時發熱 |
|
含油物質 |
油渣(含乾性油) 油布(含乾性油) 含油活性白土 |
由油脂之氧化熱而起燃 由油脂之氧化熱而起燃 由油脂之氧化熱而起燃 |
|
氣體 |
氧氣 乙炔 |
洩漏或反覆壓縮時起燃 曳漏或反覆壓縮時起燃 |
|
具有氧化性之物質 |
硫酸、硝酸 過氧化氫 硝酸鈉、氯酸鈉 亞氯酸鈉 過氧化苯甲醯 甲乙基酮過氧化物 過氧化鈉 高錳酸鉀 溴酸鉀 疊氮化合物 紅磷 |
加有機物或藥品時起燃 加有機物或藥品時起燃 加有機物或藥品時起燃 由高溫或重擊時起燃 重擊下易爆炸 加金屬類強鹼,氧化物時易爆炸 與藥品接觸或加水時起燃 加有機物或藥品時起燃 加有機物或藥品時起燃 由餘熱而起燃 由摩擦,重擊而起燃 |
表4 由氧化性物與還原性物之組合能起燃或爆炸之組合
|
氧 化 性 物 |
還 原 性 物 |
備 註 |
|
氯酸鹽、過氯酸鹽 高錳酸鹽、硝酸鹽 重鉻酸鹽及過氧化物 |
硫黃、木碳、金屬類、磷、硫化銻、有機物 |
由摩擦、重擊、加熱時易發生危險 |
|
過氧化氫(高濃度) 水溶液 |
金屬類、粉塵、金屬氧化物、有機物 |
急速加入時放出大量氧氣 |
|
濃硝酸 |
磷化氫、硫化氫、或其他有機物 |
|
|
苦味酸 |
有機物 |
|
|
無水鉻酸 |
苯胺、辛那、丙酮、無水醋酸、乙醇、黃油 |
起火或爆炸 |
|
液態空氣 |
氫氣、甲烷、乙炔、鈉金屬、金屬類 |
爆炸 |
|
液態氧 |
氫氣、甲烷、乙炔、鈉金屬、金屬類 |
爆炸 |
|
氯氣 |
黃磷、乙炔、氨氣 |
起燃 |
|
溴 |
金屬類 |
起燃 |
六、理論空氣量
維持繼續燃燒需不斷地供應空氣,但空氣量過多時燃燒瓦斯之溫度降低熱效率則變低,當空氣量過少則成為不完全燃燒。為保持完全燃燒所需最少空氣量稱為理論空氣量。
(1)燃料之理論空氣量
對碳為主之燃料而言,燃燒時有下列反應
C + O2→CO2
當12g碳與22.4L氧反應時生成22.4L二氧化碳,易燃物在空氣中燃燒時倘需計算理論空 氣量時依下列方法則可。
空氣中氧與氮之比例為21:79,為燃燒lkg純碳時
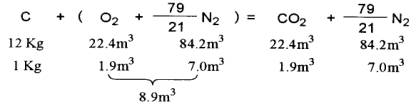
依上式為燃燒1kg純炭時則需8.9m3空氣。再以甲烷及丙烷在燃燒時所需空氣以下式而得。

七、燃燒界限
可燃性蒸氣或瓦斯在空氣中(氧氣中)其濃度在該物質特有之範圍內存在時始能起燃。濃度過低時因易燃性瓦斯之不足而無法燃燒,能點燃易燃性瓦斯所需最低濃度稱為燃燒下限(Lower limit),但超出某一濃度時因氧氣之不足無法起燃,能被點燃之最高濃度稱為燃燒上限(Upper Limit),燃燒下限與燃燒上限之間只要供應適當能量時則可起燃(或爆炸),上下限之間稱為燃燒(或爆炸)範圍(F1ammab1e Limit or Explosion Limit)。燃燒上下限依各危險物品而異。以氫氣為例其燃燒下限為4%上限為75%(圖3)。其他化合物之上下限則示於表5
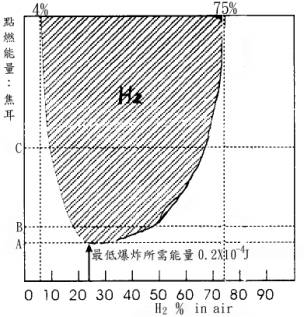
圖3 氫氣之爆炸界限
註:燃燒範圍
燃燒界限通常對可燃性瓦斯或蒸氣之混合瓦斯之容量(%)表示,燃燒下限濃度L(Vol.%) 與燃燒熱Q(Kcal/mol)之間有下式之關係
L.Q=Const.(Burgess-Wheeler式)
L與Q有反比之關係,碳氫化合物時其平均值為L.Q= ll,000 (Kcal/mol)
八、混合瓦斯之燃燒界限計算例
二種以上之可燃性瓦斯或蒸氣混合物之燃燒界限可用路.謝多列法則計算而得。依此法則可燃性瓦斯或蒸氣之種類為a、b、c…,單獨存在時之瓦斯燃燒界限各為La、Lb、Lc(%)時混合瓦斯之燃燒界限Ln(%)為
|
Ln(%)= |
100 |
…………………(1) |
|
(Pa/La)
+ (Pb/Lb) + (Pc/Lc) |
Pa、Pb、Pc = a、b、c..........混合瓦斯之容量(%)
Pa + Pb + Pc•••=100
設有H2 30%,CO 15%,CH4 55%之混合物以計算燃燒界限時H2、CO、CH4之燃燒上限各為75%,74%及15%,下限各為4.0%,12.5%及5%,所以
|
上限 = |
100 |
=23.4(%)…………………(2) |
|
(30/75)
+ (15/74) + (55/15) |
|
下限 = |
100 |
=5.2(%)…………………(3) |
|
(30/4.0)
+ (15/12.5) + (55/5.3) |
當可燃性混合瓦斯加入非燃性瓦斯如CO2時可依下列方式計算燃燒範圍。
圖4. 燃燒熱與燃燒下限(12) 圖5. 可燃性瓦斯與非燃性瓦斯在空氣中之燃燒界限(12)
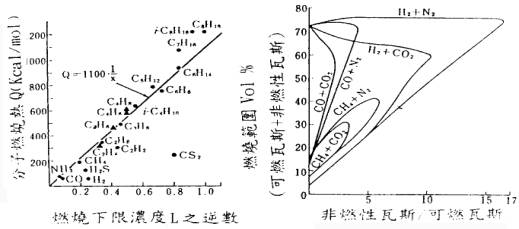
可燃性混合氣體當加入不活性氣體如CO2時燃燒範圍可自圖5及(1)式計算
例:設有H2 30%,N2 30%,CO2 30%,CO 10%之混合氣其燃燒範圍1/
N2 30%及H2 15%之混合氣為a
CO2 30%及H2 15%之混合氣為b
CO 10%之氣體為c
此時a及b自圖5得a:上限75%,下限13%,b:上限67%下限13%。
因CO之上限為74%。下限12.5%,混合瓦斯之燃燒界限為
|
上限 = |
100 |
=71(%) |
|
(45/75) + (45/67) + (10/74) |
|
下限 = |
100 |
=13(%) |
|
(45/13) + (45/13) + (10/12.5) |
通常可燃性瓦斯在一定濃度下壓力上升時燃燒範圍變寬,理由為溫度上升反應速度變大,產生熱則大;一方面散熱速度小,下限變低,上限昇高.燃燒範圍變寬。
可燃性瓦斯加入N2、H2O(水蒸氣)、CO2等非燃性瓦斯時原有燃燒範圍變狹,再提高比例時,成為加入比熱大之不活性瓦斯愈能顯示混合氣之燃燒範圍變狹之效果。
表5 易燃物品之燃燒上下限
註:*部分係政府有關部門所特別強調其危險性之化合物
|
中文名稱 |
英文名稱 |
化學式 |
下限 LEL Vol. |
上限 UEL Vol. |
比重 水=1 |
T.H.V. |
分子量 |
|
二乙氧基乙烷 |
Acetal |
CH3CH(OC2H5)2 |
1.6 |
10.4 |
0.8 |
|
118.17 |
|
乙醛 |
Acetaldehyde |
CH3CHO |
4.0 |
60 |
0.8 |
200PPM |
44.05 |
|
*丙酮 |
Acetone |
CH3COCH3 |
2.6 |
12.8 |
0.8 |
1000PPM |
56.08 |
|
乙炔 |
Acetylene |
CH≡CH |
2.5 |
31 |
0.618 |
|
26.02 |
|
*丙烯醛 |
Acrolein |
CH2CHCHO |
2.8 |
31 |
0.84 |
0.1PPM |
56.06 |
|
丙烯睛 |
Acrylonitrile |
CH2=CHCN |
3.0 |
17 |
0.80 |
20PPM |
53.06 |
|
丙烯醇 |
Allyl alcohol |
CH2=CHCH2OH |
2.5 |
18 |
0.85 |
2PPM |
58.08 |
|
3-丙烯胺 |
Allyl amine |
CH2=CHCH2NH2 |
2.2 |
22 |
0.8 |
|
57.09 |
|
3-溴丙烯 |
Allyl bromide |
CH2=CHCH2Br |
4.4 |
7.3 |
0.4 |
|
120.99 |
|
*3-氯丙烯 |
Allyl chloride |
CH2=CHCH2Cl |
2.9 |
11.1 |
0.9 |
1PPM |
76.53 |
|
氨 |
Ammonia |
NH3 |
16 |
25 |
0.77 |
50PPM |
17.03 |
|
戌醇 |
Amyl alcohol |
CH3(CH2)3CH2OH |
1.2 |
10.0 |
0.8 |
100PPM |
38.15 |
|
戌胺 |
Amyl amine |
C5H13N |
2.2 |
22 |
0.8 |
|
87.16 |
|
氯戌烷 |
Amyl chloride |
CH3(CH2)3CH2 Cl |
1.6 |
8.6 |
0.9 |
|
106.6 |
|
*苯 |
Benzene |
C6H6 |
1.3 |
7.1 |
0.9 |
10PPM |
78.11 |
|
氯甲苯 |
Benzyl Chloride |
C6H5CH2Cl |
1.1 |
|
|
|
126.59 |
|
二環己烷 |
Bicylohexyl |
(CH2(CH2)4CH)2 |
0.7 |
5.1 |
0.9 |
|
166.10 |
|
苯基苯 |
Biphenyl(Diphenyl) (Phenylbenzene) |
C6H5C6H5 |
0.6 |
5.3 |
1.2 |
|
154.20 |
|
*丁二烯 |
Butadiene |
CH2=CHCH=CH2 |
|
|
|
1000PPM |
54.09 |
|
丁烷 |
Butane |
CH3CH2CH2CH3 |
1.9 |
8.5 |
0.6 (液態) |
|
58.12 |
|
乙酸丁酯 (醋酸丁酯) |
Butyl acetate |
CH3COOC4H9 |
1.7 |
7.6 |
0.9 |
150PPM |
116.16 |
|
丁醇 |
Butyl alcohol (1-Butanol) (Propylcarbinol) (Propyl methanol) |
CH3(CH2)2CH2OH |
1.4 |
11.2 |
0.8 |
|
74.12 |
|
丁胺 |
Butyl amine (1-Amino Butane) |
C4H9NH2 |
1.7 |
9.3 |
0.3 |
150PPM |
73.14 |
|
丁基苯 |
Butylbenzene |
C6H5C4H9 |
0.8 |
5.8 |
0.9 |
|
134.21 |
|
氧化丁烯 |
Butylene oxide |
(CH3)2COCH2 |
1.5 |
18.3 |
0.83 |
|
72.02 |
|
丁醛 |
Butyraldehyde (Bytaldehyde) |
CH3(CH2)2CHO |
2.5 |
12.5 |
0.8 |
|
72.10 |
|
二硫化碳 |
Carbon disulphide |
CS2 |
1.3 |
50.0 |
1.3 |
20PPM |
76.14 |
|
一氧化碳 |
Carbon monoxide |
CO |
12.5 |
74 |
|
50PPM |
28.01 |
|
|
Carbon Oxysulfide (Carbonyl Sulfide) |
COS |
12 |
29 |
2.1 |
|
60.0 |
|
氯苯 |
Chlorobenzene (Chlorobenzol) (Monochlorobenzene) (Phenyl chloride) |
C6H5Cl |
1.3 |
7.1 |
1.1 |
75PPM |
112.56 |
|
2-氯丁二烯 |
2-Chloro-1,3 Butadiene (Chloobutadiene) (Chloroprene) |
CH2=CCl-CH=CH2 |
4.0 |
20.0 |
1.0 |
|
88.49 |
|
氯 |
Chlorine |
Cl2 |
|
|
|
1PPM |
70.92 |
|
2-氯丙烯 |
2-Chloro propylene (2-Chloropropene) |
CH3CCl=CH2 |
4.5 |
16 |
0.93 |
|
76.45 |
|
三氟氯乙烯 |
Chlorotrifluoro-ethylene |
FCCl=CF2 |
8.4 |
38.7 |
|
|
116.40 |
|
環己烷 |
Cyclohexane (Hexahydrobenzene) (Hexamethylene) |
C6H12 |
1.3 |
8 |
0.8 |
300PPM |
84.16 |
|
環己醇 |
Cyclohexanol (Hexalin) (Hydralin) |
C6H11OH |
|
|
1.0 |
50PPM |
100.16 |
|
環己酮 |
Cyclohexanone (Pimelic Ketone) |
C6H10O |
1.1 |
8.1 |
0.9 |
50PPM |
98.15 |
|
環丙烷 |
Cyclopropane (Trimethylene) |
(CH2)3 |
2.4 |
10.4 |
0.72 |
|
42.08 |
| 鄰二氯苯 |
0-Dichlorbenzene (0-Dichlorobenzol) |
C6H4Cl2 |
2.2 |
9.2 |
1.3 |
50PPM |
147.01 |
|
1.2二氯乙烷 |
1,2-Dichloroethane |
CH3CHCl2 |
|
|
|
50PPM |
98.92 |
|
1.2二氯乙烯 |
1,2-Dichloroethylene |
ClCH=CHCl |
9.7 |
12.8 |
1.3 |
200PPM |
96.92 |
|
二乙胺 |
Diethylanine |
(C2H5)2NH |
1.8 |
10.1 |
0.7 |
25PPM |
73.14 |
|
二氟氯乙烷 |
Difluoro-Chlororethane |
CF2ClCH3 |
6.2 |
17.9 |
1.12 |
|
100.47 |
|
二甲胺 |
Dimethylamine |
(CH3)2NH |
2.8 |
14.4 |
0.68 |
10PPM |
45.08 |
|
*二甲基甲醯胺 |
Dinethyl Formamide D.M.P |
HCON(CH3)2 |
2.2 |
15.2 |
0.9 |
10PPM |
73.09 |
|
偏二甲胼 |
1,1-Dimethyl-hydrazine |
(CH3)2NNH2 |
2 |
95 |
0.8 |
1mg/m3 |
60.10 |
|
二甲基硫 |
Dimethyl Sulfide |
(CH3)2S |
2.2 |
19.7 |
0.8 |
|
66.15 |
|
二甲亞硫 |
Dimethyl Sulfoxide |
(CH3)2SO |
2.6 |
28.5 |
1.1 |
|
93.1 |
|
二聚戊烯 |
Dipentene |
C10H16 |
0.7 |
6.1 |
0.9 |
|
136.23 |
|
環氧-(1,2)-氨-(3)-丙烷 |
Epichlorohydrin |
CH2CHOCH2Cl |
3.8 |
21.0 |
1.2 |
5PPM |
92.53 |
|
乙烷 |
Ethane |
C2H6 |
3.0 |
12.5 |
0.45 |
|
30.07 |
|
*乙醇胺 |
Ethanolamine |
NH2CH2CH2OH |
|
|
1.01 |
3PPM |
61.08 |
|
*乙酸乙酯 |
Ethylacetate |
CH3COOC2H5 |
2.2 |
11.0 |
0.9 |
400PPM |
38.10 |
|
*丙烯酸乙酯 |
Ethyl Acrylate |
CH2=CHCOOC2H5 |
1.3 |
|
0.9 |
25PPM |
100.11 |
|
乙醇 |
Ethyl Alcohol (Ethanol) |
C2H5OH |
3.3 |
19 |
0.8 |
1000PPM |
46.07 |
|
乙胺 |
Ethylamine |
C2H5NH2 |
3.5 |
14.0 |
0.8 |
|
45.08 |
|
乙苯 |
Ethylbenzene |
C2H5C6H5 |
1.0 |
6.7 |
0.9 |
100PPM |
106.16 |
|
溴乙烷 |
Ethyl Bromide |
C2H5Br |
6.7 |
11.3 |
1.4 |
200PPM |
108.98 |
|
乙基氯 |
Ethyl Chloride |
C2H5Cl |
3.8 |
15.4 |
0.9 |
1000PPM |
64.52 |
|
環乙基戊烷 |
Ethylcyclopentane |
C2H5C5H9 |
1.1 |
6.7 |
0.8 |
|
98.07 |
|
乙烯 |
Ethylene |
H2C=CH2 |
2.7 |
36.0 |
0.57 |
|
28.05 |
|
二氯乙烷 |
Ethylene-Dichloride Ethulene Glycol Monoacetate Ethylene Glycol Monoethyl Ether |
CH2ClCH2Cl CH2OHCH2OOCCH3 HOCH2CH2OC2H5 |
6.2 1.8 |
16 14.0 |
1.3 1.1 0.9 |
200PPM |
98.96 104.10 90.12 |
|
*己烷 |
Hexane |
CH3(CH2)4CH3 |
1.1 |
7.5 |
0.7 |
500PPM |
86.17 |
|
甲丁酮 |
3-Hexanone |
C2H5COC3H7 |
1.1 |
8 |
0.82 |
|
100.16 |
|
*醯胼 |
Hydrazine |
H2NNH2 |
2.9 |
98 |
1.0 |
1PPM |
32.05 |
| 氫氣 |
Hydrogen |
H2 |
4.0 |
75 |
|
|
2.016 |
|
氰化氫 |
Hydrogen Cyanide |
HCN |
5.6 |
40.0 |
0.7 |
10PPM |
27.03 |
|
硫化氫 |
Hydrogen Sulfide |
H2S |
4.0 |
44.0 |
1.185 |
20PPM |
34.08 |
|
羥胺 |
Hydroxylamine |
NH2OH |
|
|
1.2 |
|
33.03 |
|
*乙酸異戌醇 |
Isoamyl Acetate |
CH3COOCH2CH2 CH(CH3)2 |
1.0 |
7.5 |
0.9 |
100PPM |
130.19 |
|
*異戌醇 異丁烷 |
Isoamyl Alcohol Isobutane |
(CH3)2CHCH2OH (CH3)3CH |
1.2 1.8 |
9.0 8.4 |
0.8 |
100PPM |
88.15 58.04 |
|
*乙酸異丁醇 |
Isobutyl Acetate |
CH3COOCH2CH(CH3)2 |
2.4 |
10.4 |
0.9 |
150PPM |
116.16 |
|
*異丁醇 異丁苯 |
Isobutyl Alcohol Isobutylbenzene |
(CH3)2CHCH2OH (CH3)2CHCH2C6H5 |
1.2 0.82 |
10.9 6.0 |
0.8 0.9 |
10PPM |
72.14 134.21 |
|
異丁基氨 異丁基甲酸 |
Isobutyl Chloride Isobutyl Formate |
(CH3)2CHCH2Cl HCOOCH2CH(CH3)2 |
2.0 1.7 |
8.8 8 |
0.9 0.88 |
|
92.53 102.13 |
|
*乙二酸甲醚 環氧乙烯 |
Ethylene Glycol Ethylene Oxide |
CH3OCH2CH2OH CH2OCH2 |
2.5 3.6 |
14.0 100 |
1.0 0.9 |
25PPM 50PPM |
76.09 44.05 |
|
乙醚 乙基甲酸 |
Ethyl Ether Ethyl Formate |
C2H5OC2H5 HCO2C2H5 |
1.9 2.8 |
36.0 16.0 |
0.7 0.9 |
400PPM 100PPM |
74.12 74.08 |
|
乙硫醇 |
Ethyl Mercaptan |
C2H5SH |
2.8 |
18.0 |
0.8 |
0.5PPM |
62.03 |
|
硝酸乙酯 |
Ethyl Nitrate |
CH3CH2ONO2 |
4.0 |
|
1.1 |
|
91.07 |
|
亞硝酸乙酯 |
Ethyl Nitrite |
C2H5ONO |
3.0 |
50 |
0.9 |
|
75.07 |
|
丙酸乙酯 |
Ethyl Propionate |
C2H5COOC2H5 |
1.9 |
11 |
0.9 |
|
102.13 |
|
乙丙基醚 |
Ethyl Propyl Ether |
C2H5OC3H7 |
1.7 |
9.0 |
0.8 |
|
83.05 |
|
*甲醛 |
Formaldehyde |
HCHO |
7.0 |
73 |
0.815 |
5PPM |
30.03 |
|
燃料油 (煤油) |
Fuel oil no.1 |
|
0.7 |
5 |
1 |
|
- |
|
汽油 |
Gasoline |
C5H12到C9H20 |
1.3 |
6.0 |
0.3 |
500PPM |
- |
|
庚烷 |
Heptane |
CH3(CH2)CH3 |
1.05 |
6.7 |
0.7 |
500PPM |
100.20 |
|
異丁醛 異庚烷 異己烷 |
Isobutyraldehude Isoheptane Isohexane |
(CH3)2CHCHO (CH3)2CHC4H9 (CH3)2CHC3H7 |
1.6 1.0 1.0 |
10.6 6.0 7.0 |
0.8 0.7 0.7 |
|
72.10 |
|
異戌烷 |
Isopentane |
(CH3)2CHCH2CH3 |
1.4 |
7.5 |
0.6 |
|
72.30 |
|
*乙酸異丙酯 |
Isopropyl Acetate |
(CH3)2CHOOCCH3 |
5.8 |
8 |
0.9 |
250PPM |
102.13 |
|
*異丙醇 |
Isopropyl Alcohol |
(CH3)2CHOH |
2.0 |
12 |
0.8 |
400PPM |
60.09 |
|
異氯丙烷 |
Isopropyl Chloride |
(CH3)2CHCl |
2.8 |
10.7 |
0.5 |
|
78.54 |
|
異丙醚 |
Isopropyl Ether |
(CH3)2CHOCH(CH3)2 |
1.4 |
7.9 |
0.7 |
|
102.17 |
|
噴射燃料 |
Jet Fuel |
JP-4 |
1.3 |
8.0 |
|
|
- |
|
甲烷 |
Methane |
CH4 |
5.0 |
15.0 |
|
|
16.04 |
|
*甲醇 (木精) |
Methanol (Methyl Alcohol) |
CH3OH |
6.7 |
36 |
0.8 |
200PPM |
32.04 |
|
*乙酸甲酯 |
Methyl Acetate |
CH3COOCH3 |
3.1 |
16 |
0.9 |
200PPM |
116.12 |
|
丙烯酸甲酯 |
Methyl Acrylate |
CH2=CHCOOCH3 |
2.8 |
25 |
1.0 |
10PPM |
86.09 |
|
甲胺 |
Methylamine |
CH3NH2 |
4.9 |
20.7 |
|
|
31.06 |
|
溴甲烷 |
Methyl Bromide 2- Methyl-2-Butane 3- Methyl-1-Butene |
CH3Br (CH3)2CHCH2CH3 (CH3)2CHCH3CH3 |
1.2 1.5 |
9.0 9.1 |
0.8 0.6 |
|
94.95 |
|
*甲丁酮 |
Methyl Butyl Ketone |
ClI3COC4H9 |
1.2 |
8 |
0.8 |
100PPM |
100.16 |
|
氯甲烷 |
Methyl Chloride |
CH3Cl |
10.7 |
17.4 |
0.92 |
|
50.49 |
|
二氯甲烷 |
Methylene Chloride |
CH2Cl2 |
15.5 |
66 |
1.3 |
500PPM |
84.9 |
|
二甲醚 |
Methyl Ether |
(CH3)2O |
3.4 |
27 |
0.661 |
9PPM |
46.07 |
|
苯乙烯 |
Styrene |
C6H5.CH:CH2 |
1.2 |
8.9 |
|
100PPM |
104.14 |
|
四氯乙烯 四氫化呋喃 |
Tetrachloroethylene Tetrahydrofuran (Diethylene Oxide) |
C2Cl4 C4H8O |
2 |
11.8 |
0.9 |
100PPM 200PPM |
165.85 72.10 |
|
四氫化呋喃甲醇 |
Tetrahydrofurfuryl Alcohol |
C4H7OCH2OH |
1.5 |
9.7 |
1.1 |
|
102.13 |
|
四氫荼 |
Terahydronaphthalene |
C6H2(CH3)2C2H4 |
0.8 |
5.0 |
1.0 |
|
132.20 |
|
甲苯 |
Toluene |
C6H5CH3 |
1.1 |
7.1 |
0.9 |
100PPM |
92.13 |
| 2,4二異氰酸 |
Toluene-2,4-Diisocyanate |
CH3C6H3(NCO)2 |
0.9 |
9.5 |
1.2 |
0.02PPM |
174.15 |
|
三氯乙烯 |
Trichloroethylene |
ClHC:CCl2 |
12.5 |
90 |
1.5 |
100PPM |
131.40 |
|
三乙胺 三乙烯醇 三氟氯乙烯 |
Triethylamine Triethylene Glycol Trifluorochloroethylene |
(C2H5)3N HOCH2(CH2OCH2)2 CH2OH CF2:CFCl |
1.2 0.9 24.0 |
8.0 9.2 40.3 |
0.7 1.1 1.31 |
25PPM |
101.19 150.17 116.47 |
|
醋酸乙烯 |
Vinyl Acetate |
CH2:CHOOCCH3 |
2.6 |
13.4 |
0.9 |
|
36.09 |
|
醋酸乙炔 |
Vinyl Acetylene |
CH2:CHC:CH |
21 |
100 |
0.69 |
|
52.04 |
|
甲乙醚 |
Methyl Ethyl Ether |
CH3OC2H5 |
2.0 |
10.1 |
0.7 |
|
61.07 |
|
*丁酮 |
Methyl Ethyl Ketone |
C2H5COCH3 |
1.8 |
10 |
0.8 |
200PPM |
72.12 |
|
甲酸甲酯 |
Methyl formate |
CH3OOCH |
5.0 |
23 |
1.0 |
100PPM |
50.05 |
|
甲胼 |
Methylhydrazine |
CH3HNNH2 |
4.0 |
|
0.9 |
0.2PPM |
46.07 |
|
*甲基異丁酮 |
Methyl Isobutyl Ketone |
CH3COCH2CH(CH3)2 |
1.4 |
7.5 |
0.8 |
100PPM |
100.16 |
|
乳酸甲酯 |
Methy Lactate |
CH3CHOHCOOCH3 |
2.2 |
|
1.1 |
|
104.10 |
|
甲硫醇 |
Methyl Mercaptan |
CH3SH |
3.9 |
21.8 |
0.9 |
0.5PPM |
48.10 |
|
2-甲基丙烷 |
2-Methylpropane Methyl propionate |
CH3CH2COOCH3 |
1.0 2.0 |
9.6 1.3 |
0.9 |
|
88.10 |
|
戌酮 |
Methyl propyl Ketone |
CH3COC3H7 |
1.5 |
8.2 |
0.8 |
200PPM |
86.13 |
|
*石腦油 |
Napahtha |
|
0.9 |
6.0 |
|
200PPM |
- |
|
*硝基苯 |
Nitrobenzene |
C6H5NO2 |
1.2 |
4.3 |
|
|
123.11 |
|
戌烷 |
Pentane |
CH3(CH2)3CH3 |
1.5 |
7.8 |
0.6 |
1000PPM |
72.15 |
|
戌醇 |
3-Pentanol |
CH3CH2CH(OH)CH2CH3 |
1.2 |
9.0 |
0.8 |
|
98.15 |
|
順戌烯 |
1-Pentene-cis |
CH3(CH2)2CH:CH2 |
1.5 |
8.7 |
0.7 |
|
70.13 |
|
石油醚 |
Petroleum Ether |
- |
1.1 |
5.3 |
0.6 |
|
- |
|
丙醛 |
Propanal (Propionaldehyde) |
CH3CH2CHO |
2.9 |
17.0 |
0.8 |
|
58.08 |
|
丙烷 |
Propane |
CH3CH2CH3 |
2.2 |
9.5 |
0.58 |
1000PPM |
44.09 |
|
*乙酸丙酯 |
Propyl Acetate |
C3H7OOCCH3 |
2.0 |
8 |
0.9 |
|
102.13 |
|
丙醇 |
Popyl Alcohol |
CH3CH2CH2OH |
2.1 |
13.5 |
0.8 |
200PPM |
60.09 |
|
丙胺 |
Propylamine |
CH3(CH2)2NH2 |
2.0 |
10.4 |
0.7 |
|
59.11 |
|
丙苯 |
Propylbenzene |
C3H7C6H5 |
0.8 |
6.4 |
0.9 |
|
120.19 |
|
氯丙烷 丙烯 1,2二氯丙烷 |
Propyl Chloride Propylene Propylene Dichloride |
C3H7Cl CH2CHCH3 CH3CHClCH2Cl |
2.6 2.0 3.4 |
11.1 11.1 14.5 |
0.9 0.51 1.2 |
|
78.48 42.08 113.93 |
|
1,2丙二醇 |
Propylene Glycol |
CH3CHOHCH2OH |
2.6 |
12.5 |
1.0 |
|
76.09 |
|
1,2環氧丙烷 |
Propylene Oxide |
OCH2CHCH3 |
2.8 |
37.0 |
0.9 |
100PPM |
58.08 |
|
丙炔 |
Propyne(Allylene) |
CH3C:CH |
1.7 |
|
|
|
40.03 |
|
氯化乙烯 |
Vinyl Chloride |
CH3CHCl |
3.6 |
33 |
0.9 |
500PPM |
62.50 |
|
*丙烯睛及其他丙烯睛類化合物 |
Vinyl Cyanide (Acrylonitrite) Vinyl Ethyl Alclohol Vinyl Ethyl Ether Vinylidene Chloride Vinylidene Fluoride |
CH2:CHCN CH2:CH(CH2)2OH CH2:CHOC2H5 CH2:CCl2 CH2:CF2 |
3.0 4.7 1.7 7.3 5.5 |
17 34 28 16 21.3 |
0.8 0.84 0.8 1.3 |
20PPM 25PPM |
53.06 72.02 72.04 96.95 64.02 |
|
*二甲苯 |
Xylene |
C6H4(CH3)2 |
1.1 |
7.0 |
0.9 |
100PPM |
106.16 |
九、蒸氣密度與引火性之難易
自然界中大多數之蒸氣密度大於空氣。於是易沈降蓄積在低窪處。蒸氣較空氣輕者穿透空氣向上漂浮,相反者往下沈。以低分子之碳氫化合物為例,天然氣以甲烷(CH4)為主成分,漏洩時在天花板附近之濃度最高,接近於地上之濃度最低,其中間帶成為爆炸範圍。再以液化石油氣(C3H8及C4H10)為例,漏洩時其蒸氣密度比空氣重,所以其蒸氣往下沈,倘有排水溝而能流出場外。此時上面之蒸氣密度稀薄而下面濃度高,中間帶則成為燃燒範圍。參考圖6
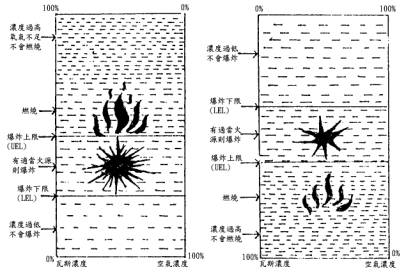
圖6 易燃瓦斯-空氣混合物之密度與爆炸難易之關係
(左圖CH4,右圖C3H8)
如圖6所示,事前能預知易燃性瓦斯究竟比空氣重或輕則可利用為防災及爆炸後之鑑析參考。化合物以蒸氣或瓦斯狀態存在時其相關密度可自產生蒸氣之化合物之分子量與相關空氣之分子量(約為29)依下式求出:
|
瓦斯之蒸氣密度= |
瓦斯之分子量 |
|
空氣之分子量 |
以CH4為例,CH4之V.D.(Vapor
Density)=16/29=0.55
(註:C=12,H=1.0)
再以C3H8為例,C3H8之V.D.=44/29=1.52
由此案例。天然氣漏洩時其V.D.為0.55所以往上漂,液化石油氣係丙烷、丁烷等之混合物。丙烷本身之V.D.為1.52因此往下沈。爆炸案件發生時倘有此種基本常識或對爆炸之前因後果之判斷有所幫助。至於能揮發之易燃液體可產生多少量之蒸氣則參考消防化學(II)。
十、熱化學方程式
化學方程式中除了表示反應產物外尚有反應熱者稱為熱化學方程式,而發熱以+,吸熱以-表示。
H2(gas)+1/2 O2(gas) → H2O(gas) + 57.6 Kca1
H2(gas)+1/2 O2(gas) → H20(1iq) + 68.4 Kca1
在上式中68.4-57.6=10.8 KCal屬1mol水之蒸發潛熱。
含氫燃料於燃燒後產生水蒸氣,所以發熱量有二,通常採水蒸氣變為水時之較大數值(高發熱量)為多。
例:
1g原子之碳與1mol氧生成1mol CO2時
C+O2→CO2+97.0 Kcal
在高溫下部分CO2會轉為CO,此時則屬吸熱反應
C+O2→2CO-38.2 Kca1
實用上與反應有關之物質,氣體時用m3,固體時用kg表示。
H2+1/2 O2→H2O (液體)+3050 Kca1/m3 H2
C+O2→CO2+8080 Kca1/kg
上式各表示1m3氫燃燒時得3050 Kcal之熱及1kg碳燃燒時得8080Kcal之意。
第二節 物質之化學反應
一、反應熱(Heat of reaction)
反應熱指發生化學反應時產生或吸收之熱量而言,化學反應約可分為數項:
A+B→AB………………化合
AB→A+B………………分解
AB+C→AC+B…………置換
AB+CD→AC+BE………複分解
A×n→An…………………聚合
設物質A,B………各有n1,n2…………莫耳反應時
n1A+n2B+……n1'C+n2'D+…+Q(cal)
Q為反應熱,以純碳為例在空氣中燃燒時
C(s)+O2(g) →CO2(g)+94,400 cal
上式表示純碳12克與1莫耳氧反應產生1莫耳二氧化碳22.4公升及94,400cal熱量。
二、生成熱(Heat of formation)
某物質由構成元素直接產生時其反應熱則為生成熱。化學反應之反應熱係生成物質之生成熱之和減去反應物質生成熱之和,以CO為例:
CO(g)+H2O(g)→CO2(g)+H2(g)
此時之生成熱為QCO2=94,380,QCO=26,700,QH2O=57,900所以
反應熱為94,380-57,900-26,700=9,780 cal
生成熱也能自燃燒熱計算,生成物之生成熱之和減去化合物之燃燒熱則可。
以乙醛為例:CH3CHO+O2→2CO2(g)+2H2O(l)
因為生成熱為:CO2=94.38 Kcal,H2O=68.38 Kcal而CH3CHO之燃燒為279.0 Kcal。
∴2×(94.38)+2×(68.38)-279.0=46.52 Kcal/mol
對乙炔而言
C2H2+5×1/2 O2→2CO2+H2O
∴2×(94.38)+68.38-312=-54.86 Kcal/mol
碳氫化合物之生成熱來自C及H之生成熱加 H2O 之生成熱再減去碳氫化合物之燃燒熱:QF=94.38×(n)+68.38(m/2)-QC
註:碳氫化合物 (CnHm),QC:碳氫化合物之燃燒熱 (cal/mole)
三、燃燒熱
物質由氧氣完全燃燒時產生之熱,通常以1莫耳之熱量表示。燃燒熱有定容燃燒熱與定壓燃燒熱之分,使用熱量計(Calorimeter)測定時屬於定容燃燒熱Qv,至於Qp由下式而得:
Qp=Qv-nRT
物質之生成熱可自燃燒熱計算,有機物中難以直接計算生成熱者用燃燒熱計算。以苯為例其生成熱為:
C6H6(l)+15/2 O2=6CO2+3H2O(l)+782,700
C6H6(l)=C6H6(g)-7,500
6C(石墨)+3H2(g)=C6H6(g)+Qp
Qp=6×(94,300)+3×(68,300)-(782,700+7,500)=-19,500實用上1公斤物質之燃燒熱稱為發熱量而以Kcal/kg表示。
表6物質之生成熱(kcal/mol)(3,7,11)
|
名稱 |
生成熱 |
名稱 |
生成熱 |
名稱 |
生成熱 |
|
CH4 |
17.7 |
C8H10 |
5.9 |
HCl(dil) |
39.46 |
|
C2H6 |
20.2 |
C7H8 |
-2.9 |
HNO3(dil) |
49.80 |
|
C3H8 |
24.8 |
C6H6 |
-11.8 |
HO2(l) |
63.38 |
|
C4H10 |
29.7 |
C2H4 |
-12.5 |
SO2(g) |
69.30 |
|
C5H12 |
34.9 |
C2H2 |
-54.7 |
CO2(g) |
94.38 |
|
C6H12 |
37.2 |
|
|
H2SO4(dil) |
207.5 |
表7物質之燃僥熱(kcal/mol)(2,12)
|
名稱 |
燃燒熱 |
名稱 |
燃燒熱 |
名稱 |
燃燒熱 |
|
CO |
68.1 |
CH4 |
212.8 |
C3H8 |
530.5 |
|
H2 |
68.3 |
CS2 |
265.6 |
C4H10 |
687.9 |
|
S |
69.3 |
C2N2 |
271.4 |
C6H6 |
789.0 |
|
NH3 |
75.7 |
PH3 |
277.5 |
C6H5CH3 |
943 |
|
C(石墨) |
94.0 |
C2H2 |
312.4 |
C6H14 |
1,003 |
|
H2S |
132.9 |
C2H5OH |
336.7 |
C6H4(CF3)2 |
1,088 |
|
CH3OH |
182.5 |
C2H4 |
337.2 |
C10H8 |
1,220 |
|
CH3COOH |
202.0 |
C2H6 |
372.8 |
C14H10 |
1,685 |
瓦斯之燃燒熱應在一定溫度及一定壓力下在乾燥狀態以Kcal/m3表示,欲換算在前後不同溫度、壓力、濕度之燃燒瓦斯之燃燒熱時將舊條件下之燃燒熱除以新條件下之容積則可:
H1/H2=V1/V2
Hi:舊瓦斯之燃燒熱,Vi:新條件下之瓦斯容積
四、連鎖反應(Chain reaction)
燃燒則屬於連鎖反應之一,多種化學反應並非單一種反應而是連續性之化學反應,在連續反應過程中反應生成物不斷地產生而成為下一反應之反應物,因此一旦反應開始則成一連串之連鎖反應。氯氣與氫氣之反應為例H2+Cl2→2HCl屬於連鎖反應,此反應在黑暗中無法進行,但在日光下易起反應,Cl原子與H2分子反應生成HCl,同時產生活化氫原子並與氯分子反應產生HCl及Cl原子。
火災時有複雜且有連續性之化學反應,因反應物之種類多,在極為複雜之反應過程中速度有快慢之別。連鎖反應(Chain reaction)為續發反應之一種,反應生成物依次成為下一段反應並無限繼續。如H2與Cl2反應時依下列方式進行:
H2+Cl2→2HCl
Cl2→2Cl
Cl+H2→HCl+H
H+Cl2→HCl+Cl
只要有足夠反應物之存在反應則可繼續進行。在上列反應中活化狀態之H與Cl以連鎖反應之煤介方式存在面稱為Carrier (擔體)。此反應在黑暗中殆不起作用,惟最初之擔體可由照光產生。Cl原子與H2分子反應產生HCl,同時生成活化H與Cl2分子反應成為HCl與Cl原子,HCl與Cl雖然被活化,但有不活性分子如HCl或H與Cl互相碰撞時則失去活性,當擔體減少時等於反應之結束。連鎖反應中產生不只一個連鎖擔體,生成二個擔體時反應速度增加,生成更多則接近爆炸現象。此現象稱為chain branching(連鎖分支)。對氫氧混合瓦斯而言Free radical(自由基)為OH及游離原子之O、H。此反應可藉點火步驟可產生最初之OH
OH+H2→H2O+H
H+O2→OH+O
O+H2→OH+H
上式中第一段為連鎖反應之開始,第二及第三段屬於分支反應,被消耗一個擔體時如上式所示比原來多出一個擔體,所以反應仍可急速進行。