第四章 滅火劑之理化性與滅火作用
第一節
不燃性氣體
不燃性氣體之滅火效果:只要能減少可燃物周圍之氧氣濃度則可達到滅火之目的。此形態之滅火通常稱為由稀釋效果之滅火。為此目的所用之氣體滅火劑需具備穩定之理化性及不燃性始可。如使用N2,CO2,Ar等不活性氣體時周圍之氧氣濃度逐漸被稀釋,所以需注意勿使周圍之生物窒息。
一、氮氣(N2)
以不燃性氣體稀釋空氣中之氧濃度時火焰依氧濃度之降低逐漸熄滅,以N2滅火為例氧濃度降至11~12%時燃燒則不再進行。氮與氧化合時屬於吸熱反應,而通常之火焰溫度及無催化劑存在時此反應無從產生。
二、氬(Ar)
此物不形成化合物,與氮相同以稀釋方式使用時可當作滅火劑之用,但價格昂貴用途受限制。惟金屬在極高之溫度下燃燒時與CO2或N2易形成CO或NO等化合物,此時可用氬達到滅火之目的。因高溫下不起反應之故,儲存放射性同位素之場所應使用氬或氮氣。
三、二氧化碳(CO2)
氣體滅火劑中最常用者,7公斤之二氧化碳滅火器可滅8000cm2之汽油火災。50公斤裝者可滅40000cm2之汽油火災。其特點為純度高及在國內盛產大理石之條件下CO2之使用極為普遍。CO2被加壓時易液化,故較氮氣易儲存且使用後無殘留物,通常可用於可燃性液體火災。對木材火災雖可使用惟效果不大,金屬火災時因高溫下金屬能還原二氧化碳故不宜使用,但具有良好之絕緣性故適合電氣火災。二氧化碳在高壓下易成為液化狀態,鋼瓶中之二氧化碳在貯存時應避免日光之直射及震動,並置於低溫處為宜。
二氧化碳屬於良好之滅火劑,因為不燃性其滅火作用來自於稀釋作用,液化後之二氧化碳在蒸發時部分變為固體之乾冰,昇華時能吸收大量之熱能,故尚有冷卻作用。滅火時用量較氮氣為少,對空氣1約需0.4則可。在高溫下與火焰中之碳起下列反應:
CO2+C→2(CO)
-38.4 Kcal/mole
產生之一氧化碳之毒性為MAC 100,一般火災常為不完全燃燒之故易產生數%之一氧化碳。
第二節 鹵化碳氫化合物滅火劑
一、鹵化碳氫化合物之滅火作用
碳氫化合物結構中之氫其一部分或全部以鹵原子置換時可得易蒸發之蒸發性液體滅火劑,俗稱海龍者原文為Halogenated Hydrocarbon(Halon係縮寫)。主要滅火對象為可燃性液體火災及電氣火災。此系滅火劑與二氧化碳相同,不導電且易蒸發,其滅火作用屬於抑制,冷卻及稀釋作用。滅火時需將火焰完全抑制,以免再燃。金屬火災時鹵化物易與金屬反應,故不宜使用。有水分共存時對金屬有腐蝕作用。此類滅火劑雖有多方面之優點,但使用中易產生鹵素瓦斯及光氣(COCl2,MAC 1ppm)等有毒氣體,故應避免在狹小之室內使用,其比重較其他滅火劑為大,以儲存體積而言較為經濟。近來有鑑於此系化合物破壞臭氧層之情形嚴重,其使用及製造已受管制,以後會有代替品出現。
液體燃料其大部分為碳氫化合物或其衍生物,燃燒時碳氫化合物之碳與氫之結合被切斷而與氧結合時放出能量,經數次之變化最後變成CO2及H2O,碳氫化合物在燃燒中倘加入鹵化物時鹵化物則自C-H結合奪去H而起下列反應:
Hα+Br→HBr+α
OH+HBr→H2O+Br
Hα:含氫之燃料
HBr:鹵素酸
燃料之火焰中加入鹵化物時起熱分解而產生自由基(Free radical)及鹵素原子。此原子在燃燒過程中自燃料之C-H結合奪去H或去除火焰中之OH,有此反應產生時正常燃燒受阻,並稱為連鎖中斷作用或抑制作用。
以滅火為目的所加之鹵化碳氫化合物中鹵素以外之碳氫殘基能以燃料之形態作用,所以其殘基愈不易燃燒者滅火效果愈佳(例C-F結合)。又鹵化物由碳氫化合物脫氫時之發熱量愈小者,滅火效果則大(例:Br及I),H-x型鹵化物與H之結合力過強時則不易與OH基反應而產生水及鹵化物。
搶奪鹵化物之強弱由抑制效果而言其順序為:
I>Br>Cl>F
於滅火劑之立場論穩定性時其次序為:
F>Cl>Br>I
最理想之條件為於熱分解時能放適當量之有效鹵原子,同時需具有不燃性及稀釋作用。F及Br之置換衍生物雖可符合上列條件但實際上價格亦成為重要之因素,故氯化物之效率雖低,惟價廉之故迄今仍被使用。鹵化碳氫化合物之主要優點為滅火時之使用量比不燃性氣體為少。
二、各種鹵化碳氫化合物滅火劑之理化性
(1)溴甲烷、碘甲烷(Bromomethane,Iodomethane CH3Br,CH3I)CH3Br於第二次世界大戰 時在英國普遍地被使用,係一種優秀之抑制劑。毒性(MAC 20ppm),CH3I效率較CH3Br高,但價貴,不合實用。
(2)溴氯甲烷(Chlorobromomethane
CH2BrCl)
由德國所開發而開始使用,目前效力較CCl4高兩倍,故使用量已在增加。1L
CH2BrCl可滅4000cm2汽油火災。
(3)氟氯甲烷(Chlorofluoromethane,Freon)
在市面上有下列產品:
Freon-12(CCl2F2),Freon-13(CClF3),Freon-13
B-1(CBrF3),Freon-114 B-2(BrF2C.CF2Br)以冷媒方式,應用於工業上,價廉、穩定性高,毒性較CCl4低(MAC l000ppm)滅火效果與CCl4相近,可當作引火性液體之引火點上升劑。
(4)溴氟甲烷(Bromofluoromethane)
Bromotrifluoromethane(CBrF3),Dibromodifluoromethane(CBr2F2),Bromochlorodifluoromethane(CBrClF2)等物係近來開發出來之滅火劑,效果良好但合成成本高。其中CBrF3在Halogenated H.C.中毒性最低且效果高。故適合裝成於飛機上。常溫時係氣體,加壓後裝於綱瓶,故稱為壓縮氣體滅火器。
(5)四氯化碳(Carbontetrachloride,CCl4)
通常裝於玻璃瓶或滅火器中,蒸氣係不燃性,惟毒性高(MAC l0ppm)近來已較少使用。
(6)乙烷(Ethane)等衍生物
鹵化碳氫化合物中碳鏈愈長者,其滅火效果則愈低。最近發現者有1,2-Dibromotetrafluoroethane(CBrF2.CBrF2),此物之滅火效果,純度及穩定性相當理想,0.5l裝之滅火器可減4000cm2汽油火災。
三、海龍系統滅火劑之代替品
常用海龍系滅火劑1301、1211、及2402均屬於鹵化碳氫化合物,在空氣中擴散後破壞臭氧層而對生物造成傷害是為眾知之事實,於1987年世界24個國家在蒙特婁簽署保護同溫臭氧層免遭鹵化碳氫化合物之破壞,並自1987年7月開始管制生產與消費量。削減量以1986年產量為基準,1995年1月之產量為1986年之1/2以下,而2000年1月起全部停止使用。我國雖非蒙特婁議定書會員國,但配合國際慣例自1996年開始配合實施,包括1211、1301、2402等將逐漸消失。
代替品之開發:任何滅火劑必需考慮三種要素,則滅火效果,對人體之影響及環保問題。開發後之產品仍需經過各項性能試驗及訂定設計標準。目前有3M、Great Lakes、Du Pont、Kiddle-Graviner、Wormald、ICI、Safty-Hi-Tech、American
Pacific等公司已有產品問世並在評估中。
(1)3M產品
PFC-410(C4F10)對臭氧破壞值為零(ODP=0),滅火濃度5.9% (v/v),常壓下b.p為-20℃ ,稍為類似 1301。
PFC-614(C6F14),滅火濃度為4%(v/v),b.p為56℃,與1211之效能類似。
(2)Du Pont(杜邦)產品
Fe-13(HFC-23)以 往用於冷媒,不含Cl或Br,ODP=0,滅火濃度為14%(v/v),b.p為 46.5℃,其成分為CHF3。
Fe-25(CH3CHF2)滅火濃度為10%(v/v),b.p為-12.9℃,ODP=0,又稱為海龍 25或 HFC-125。
(3)Great Lakes
Co(大湖公司)產品
FM-100(CHF2Br)Firemaster
100,又稱為海龍22-B1 (HBFC-22-B1),ODP=0.5,滅火濃度為 3.9%(v/v),b.p為-15.5℃,對人體之影響仍需評估。
FM-200(CF2CHFCF3),又稱HFC-227a,ODP=0,滅火濃度為6%,b.p為-16.4C,對人體似無影響。似可代替1301。
(4)Kiddle-Graviner Co
Grav Ex系為含Cl之碳氫化合物,ODP=0,滅火濃度為5~6%(v/v)。
(5)Wormald Co產品
Inergen之成分含有N2
50%,Ar 40%及 CO2 10%。有良好之滅火效果,不構成環保問題,但含Ar之成本較貴,可取代1301。
※ODP=Ozone Deplete Potential
第三節 泡沫滅火劑
一、泡沫滅火劑之滅火原理及種類
泡沫中所含水分有冷卻效果又覆蓋於燃料表面之泡沫層能遮斷可燃物與空氣中之氧(即遮斷效果),此種滅火劑對可燃性液體火災最有效。
泡沫滅火劑由發泡機構可分為化學泡沫與空氣泡沫(亦稱為機械泡沫)。化學泡沫劑之開發較空氣泡沫劑為早,其原理為NaHCO3與Al2(SO4)3.18H2O液混合後經化學反應產生含有CO2之泡沫,故稱為化學泡(Chemical foam)。空氣泡沫以蛋白質之水解液為主要成分,另加界面活性劑及防腐劑。發泡原理與化學泡不同,將高濃度發泡液(空氣泡原液)稀釋至一定濃度後只用機械方法與空氣混合而產生泡沫。因此,泡沫內之氣體係空氣,此點與肥皂或合成洗劑之泡沫相同。故稱為空氣泡(Air foam)或機械泡(Mechanical foam)。空氣泡沫劑依所產生泡沫之膨脹率分為低發泡型(膨脹率4~12倍)及高發泡型(膨脹率1000~2000倍)。目前對可燃性液體之火災使用低發泡型為多。常用之濃度為3%及6%兩種依儲存地帶之不同,再分為一般用及寒帶用(-15℃或-30℃),高發泡者適用於礦山之坑道火災,其目的係短時間內能注入多量泡沫以填滿火災周圍之空間以窒息效果滅火。
(1)化學泡沫劑(化學泡,Chemical Foam)
由1925年起以手提滅火器方式開始使用,其內容物由產生二氧化碳用藥劑(A~B)及泡沫 穩定劑(C)而成。
(A)劑 純度98%以上之NaHCO3
(B)劑 JIS-K 1423一級Al2(SO4)3
(C)劑 膠等穩定劑
化學泡沫對油類火災有效,但對具有消泡性之醇類、酮類等水溶性溶劑無效,故亟需開發抗醇類之化學泡沫劑。
化學泡沫通常應用於1.5×1.5m的以下之小規模油類火災,大規模火災仍以空氣泡為主。其主要原因為經濟因素外化學泡沫劑在混合時之操作不易。其流動性較空氣泡為小,對大面積之火災效果較差。但對固體表面之黏著力高,所以對固體可燃物之火災效果則佳。
(2)空氣泡沫劑(機械泡,Mechanical
foam)
對石油火災之滅火常用蛋白質水解液為主要成分之空氣泡沫劑。
空氣泡沫劑之製法:可供作水解用之蛋白質有動物血液、魚粉、大豆等蛋白質。此等物加入NaOH或Ca(OH)2以適當之溫度及時間分解,再以HCl或H2SO4中和後加入防腐劑。市販者 加上氯化鐵等安定劑,pH調節為6~7.5。其成分及黏度、比重等需符合3%或6%之標準。
原液與水之混合對3%空氣泡原液則加97%水,標明6%者可加94%水則可。
二、泡沫性能之表示法
與泡沫之性能有關之因素雖多。但最重要者,則與發泡能力有關之膨脹率與泡沫之穩定性 (泡之壽命)有關之還液(Drainage)時間。此兩者又與氣泡直徑之分佈,泡膜性質及泡膜厚度有關。
設泡沫溶液之容積為V1,完全變為氣泡後所得氣泡容積為V2時可得下式:
|
E= |
V2 |
|
V1 |
E:氣泡數(Foam number)或稱為膨脹率(Expansion
ratio)
容積 Vd之泡沫返回原有之泡沫水溶液時則稱為還液(Drainage)。
Vd體積:100×Va/V1=50(或25)所需之時間稱為50%(或25%)還液時間。滅火用泡沫之50%還液時間相當長,故則定時常用25%(1/4時間)為多。
三、泡沫之理化性:
其重要之理化性有耐熱性、流動性、耐液性及對可燃性氣體之窒息性。
(1)空氣泡之有效成份
與滅火性能關係最密切者為主成分之水解蛋白質。常用角質素(Keratin)分解水溶液以HCl將pH調節為2.8~3.0所得不澄性沈澱為(A),而稱為初期蛋白胅(Primary proteose), 其次將上溶液用NaOH中和加8倍量MeOH時有白色沈澱(B),此物之主成分為二期蛋白胅(Secondaryproteose及蛋白練(Peptone),濾液經濃縮後可得較蛋白練分子更小之物(C),由此方法所得A、B、C中具有發泡力及耐熱性者僅有(A)之部分,(B)有發泡力而無耐熱性。(C)則無發泡性及耐熱性。
(2)鐵鹽對耐熱性之影響
鐵鹽對水解蛋白質之耐熱性有極大的影響。如不加鐵鹽之原液所產生的泡沫當受輻射熱時泡沫之體積繼續減少。因在油類火災泡沫受強烈的輻射熱,此時泡沫劑有耐熱性時其體積則較最初之體積為大,其最大增加率由原液中水解蛋白質濃度(3%或6%)及所加鐵鹽之種類(氯化鐵或硫酸鐵)及量而異,但過多之鐵鹽將減少耐熱性及降低流動性,並能促進原液之老化。據實驗結果,對耐熱性最適當之膨脹率為4~8倍,此時構成氣泡之直徑愈小者,耐熱性愈佳。
(3)高膨脹泡沫劑
適合於礦山坑道火災用。發泡當初之膨脹率約有1000~1500倍,由泡沫之窒息效果而滅火。
(4)泡沫滅火劑在應用上之問題
性能之優劣可測定耐熱性,流動性及耐液性等,但無法用數字直接表示其滅火性能,故需進行大規模之滅火試驗。
據英美等國之實驗當石油火災時空氣泡之用量界限為0.025Gal/min/f2,又界限供應量提高2~3倍時滅火所需之時間並無顯著之改變。
石油火災用空氣泡原液以水解蛋白質為主要成分,6%者可貯存3~4年,3%者約有5~6年。長期之貯存原液將逐漸老化,其主要現象為膠絮狀沈澱增多。故研究防止產生沈澱以提高滅火效率。新產品之開發,蛋白質水解法及穩定劑之改善當係刻不容緩之事。
第四節 乾粉 (Dry chemicals)
此類滅火劑之優點為操作方便(粉末狀)但粉末之故易吸濕而結塊,當以輸送氣體在管中如流體之方式注入現場時流動性不易控制。
一、乾粉滅火劑之效果
依火災之種類需選擇最適當之粉末滅火劑,其滅火效果以火焰之抑制作用為主。當粉末滅火劑能以適當之濃度分佈於火焰中時火焰立即被抑制而熄滅。
氣體在燃燒時一定有火焰,火焰為氣體在高溫下進行化學反應並在發光之狀態。因此,火焰中將產生多種反應中間生成物,其中以H及OH為例:
某物質能使基(Radical)H或OH之作用變為作用緩慢之物質(M)時則成為下式:
M+OH→MOH
MOH+H→M+H2O
則OH或H隨M之消耗而減少,因此燃燒狀態由滅火劑之加入而中斷以致熄滅。粉末滅火劑對金屬化合物之滅火效果如下:
(Li<Na<K<Rb<Cs)
對鹵化物而言:
(F<Cl<Br<I)
除化學成分之外粒度對滅火效果有極大影響。單位時間內(sec)能供應之滅火劑量(g)稱為滅火劑之供應率,由實驗可知不同化合物在相同粒子直徑下受粒子之形狀,磨擦力之大小,
比重等影響,在同一壓力下其供應率各有不同。無論何種滅火劑需在充足之供應率下始能發揮滅火效果,其最低供應率依各種滅火劑之種類而異。對粒子直徑而言直徑小通常滅火效果較好。
但粒子過小時易被吹散,故不易達到遠處。對防焰作用而言:木材係纖維素為主成分,當表面被氧化或被加熱起熱分解時所產生之可燃性氣體變火焰而燃燒,此時倘能阻止熱分解等於抑制繼續產生可燃性氣體而達到滅火之目的。
二、主要乾粉滅火劑
(1)碳酸氫鈉(NaHCO3 Sodium bicarbonate)
可用於油類火災,但不適合木材火災,其作用如下式:
2NaHCO3→Na2CO3+H2O+CO2
-19.9Kcal/mole
由上式可獲知其效果來自於吸熱,水蒸氣及二氧化碳之產生而發揮抑制作用。
通常NaHCO3需加入CaCO3或MgCO3等無機鹽及金屬肥皂以增加流動性。
例: NaHCO3
97%
Mg(C18H35O2)2 1.5
MgCO3
1.0
Ca3(PO4)2
0.5
(2)碳酸氫鉀(KHCO3
Potassium bicarbonate)
以KHCO3為主成分者其滅火效果較NaHCO3佳,但易吸濕。據消防化學實驗結果顯示(28),使用於小規模火災時其效果較NaHCO3高兩倍。大規模之火災時亦可得到約有1.5倍之滅火效果。碳酸鹽價廉易入手,本身亦無毒性,故屬於一種理想之滅火劑。對汽油火災之滅火效果示於表14。
表14 鈉鹽與鉀鹽對汽油火災之滅火效果
|
滅火劑種類 |
火災面積(ft×ft) |
滅火所需 平均重量(g) |
單位面積供應率(g/sec.ft) |
|
NaHCO3 |
7 × 7 8 × 8 |
2437 不熄滅 |
6.0 4.7 |
|
KHCO3 |
7 × 7 8 × 8 9 ×9 10 ×10 11 ×11 |
1915 2008 2105 2559 不熄滅 |
6.0 4.7 3.8 3.0 2.5 |
(3)磷酸一銨[(NH4)H2PO4
Ammonium Phosphate,Monobasic]
磷酸銨鹽具有防焰作用,因價高,故加入硫酸氨或硝酸氨以粉末狀使用。此類滅火劑均對木材及油類火災有效,其4kg裝之滅火器可滅20000cm2之汽油火災。
表15 磷酸鹽粉末滅火劑之成分
|
成分 |
含量 |
|
(NH4)H2PO4 (NH4)2SO4 BaSO4 Ca3(PO4)2+[(CH3)2SiO]n(l:l) |
63% 22 13 2 |
三、其他鹽類乾粉滅火劑
鹽類之中具有防焰及抑制火焰性能者頗多,但雖有滅火效果惟是否可以利用則需考慮本身之毒性,在高溫下產生物質之毒性及與其他物質結合後所得物質對人畜之毒性而定。
TEC:由英國所開發之固體滅火劑,可黏在燃燒中之金屬表面,實用於Mg,U等金屬火災,TEC之組成如下:
BaCl2 51% ;KCl 2% ;NaCl 20%; 另加約有2.5%之Mg(C18H35O2)2
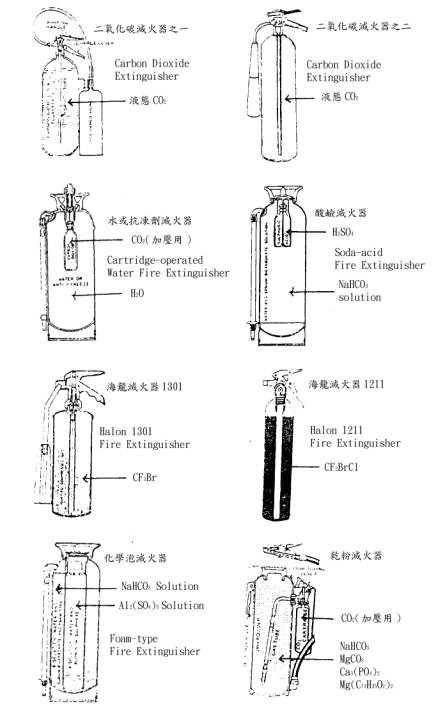
圖17手提滅火器構造及滅火劑之化學成分