第六章 化學防災
第二節 易燃 、有毒液體
一、苯,甲苯及二甲苯(Benzene, Toluene, Xylene)
苯在工業上被大量使用,除了合成化學上當作合成原料之外其他為溶劑用,而甲苯,二甲苯之用途也類似。對毒性而言屬於神經毒,由呼吸或經口進入體內後引起中毒。苯為極穩定之化學結構所以在體內不易受分解。燃燒時有大量黑煙及毒火。其易燃性及毒性以消防及預防之立場而言應加以重視。
(1)理化性質
(A)名稱,化學式,分子量
化學名:苯 (Benzene)
一般名:Benzol
化學式:C6H6
分子量:78.11
化學名:甲苯 (Toluene,
Methylbenzene)
一般名:Toluol
化學式:C6H5CH3
分子量:92.13
化學名:二甲苯(o-,m-,p-
Xylene, Dimethylbenzene)
一般名:Xylol
化學式:C6H4(CH3)2
分子量:106.16
(B)物理性質(表25)
表25 苯、甲苯、二甲苯之物理性質
|
|
苯 |
甲苯 |
二甲苯 |
||
|
o- |
m- |
p- |
|||
|
外 觀 |
無色透明液體 |
同左 |
同左 |
同左 |
同左 |
|
比 重(20℃) |
0.8790 |
0.8669 |
0.8802 |
0.8642 |
0.8611 |
|
蒸汽密度(空氣=1) |
2.73 |
3.18 |
3.66 |
3.66 |
3.66 |
|
沸 點(℃) |
80.1 |
110.6 |
144.4 |
139.1 |
138.4 |
|
熔 點(℃) |
5.5 |
-95.0 |
-25.2 |
-47.9 |
13.2 |
|
引 火 點(℃) |
-11.0 |
4.4 |
27.0 |
23.2 |
23.0 |
|
燃燒下限(vol.%) |
1.4 |
1.27 |
1.0 |
1.1 |
1.1 |
|
燃燒上限(vol.%) |
8.0 |
7.0 |
6.0 |
7.0 |
7.0 |
|
折 射 率(nd20) |
1.5011 |
1.4969 |
1.5055 |
1.4972 |
1.4958 |
(C)化學性質
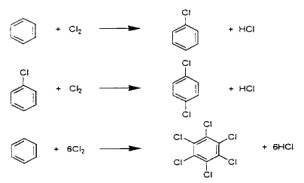
(a)核置換反應:苯,甲苯為原料在反應裝置內通入Cl2時可得多種含氯化合物,此系工業上用途甚廣。可當合成原料外亦能殺菌、殺蟲等用途但對生物有毒性,不易分解之故也構成環境污染,單苯環中著名化合物有BHC,雙環中以多氯聯苯PCB為眾人皆知之化合物。如下式所示鹵素之導入極為容易。
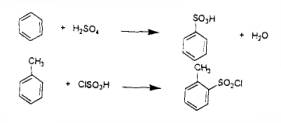
(b)以苯為原料加濃硫酸或發煙硫酸時能生成苯磺酸,此反應可用於酚合成之一階段。甲苯與氯硫磺酸作用時可得硫氯化合物。
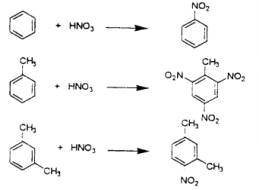
(c)苯、甲苯及二甲苯與濃硝酸作用時會產生硝基苯,三硝基甲苯、硝基二甲苯等依合成條件將產生高爆藥。
(d)加氫反應:苯用白金或鎳為催化劑在200℃前後與氫作用時能附加6原子氫而成為環已烷。此反應供作合成纖維尼龍製造。
![]()
(e)脫烷化反應:甲苯脫烷基後則生成苯。

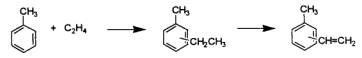
(f)烷化及脫氫反應:甲苯與乙烯反應時生成乙基甲苯,經脫氫時可得乙烯甲苯。
(g)苯核之開裂反應:苯核不受氧化,如高錳酸鉀、硝酸、重鉻酸鉀等不起作用,但在特殊條件下能氧化開裂而得直鏈化合物,以氧化釩為催化劑時用空氣就能進行氧化
![]()
(2)爆炸性及引火性
苯、甲苯及二甲苯易揮發,蒸氣屬於易燃性,在儲存,使用,運輸上需嚴禁火氣。蒸氣與空氣混合後則成為爆炸性瓦斯。
(3)對生物體之影響
吸入苯、甲苯、二甲苯蒸氣時依吸入量會引起急性或慢性中毒。據ACGIH(1976)對1日8小時勞動之加重平均濃度(TLV-TWA)各建議訂為10,100及100ppm,日本產業衛生學會亦採用同一數字。
吸入高濃度蒸氣時雖在短時間也會引起中毒。如空氣中含有2% (2000ppm)苯,甲苯及二甲苯之混合物時在此條件下5~10分鐘可能會致死。通常2000ppm以上時應認為有急性中毒之危險。中毒時有短暫之興奮期,再經麻醉狀態,康復前有1~2日宿醉狀之病狀。濃度低時經長久時間之吸入則呈慢性中毒,通常之症狀有疲勞,貧血,白血球之減少,食慾減退,消化障礙,記性衰退等。蒸氣外液狀時能自皮膚吸收,所以此系溶劑與汽油相同避免直接與皮膚接觸。
(4)分析方法
作業現場其空氣中之含量可用檢知管法直接獲知其含量,或以採氣瓶攜回以紅外線光譜儀,質譜儀均能分析。液體試樣之分析較氣體容易有多種儀器可供使用。
(5)容器
市販容器可分為鋼板製容量220公升及20公升者,玻璃製為1.1公升,內裝容量為97.5%以下,加以密封後外包裝為木箱,間隙需充填保麗龍等緩衝物。
(6)輸送上之注意
(A)玻璃瓶
以實驗室用容量而言,1磅裝,1公升裝,3公升裝為多,瓶子間應以瓦楞紙等隔開以免碰撞。
(B)18~20公升鐵罐以車輛裝貨時事先檢查封蓋是否完全能密封,卸貨時注意有無破裂或漏洩,倘有破損時立刻去除附近火苗,改裝時避免吸入蒸氣。
(C)大量輸送時常用專用運輸車,容量有:5噸,10噸,20噸鋼桶。卸溶劑時引擎停止後,確實要做到完全剎車而後應先接地下消除靜電,打開止閥去除桶內壓力再連接卸溶劑管。此過程應移去可能引火之火源。
(7)儲存上之注意
(A)儲存槽或儲存室需有避雷裝置,同時隔離明火,瓦斯爐、焊接器等火源。
(B)儲存槽勿設置在地下室,容器也勿置放在如地下室等低窪處,此系蒸氣比空氣重易沈積而造成危險。
(C)儲存場所之電氣設備需防爆。
(D)室外儲存槽應有防油堤,漏洩時可防止外流。
(E)室外儲存槽應設直徑25mm以上之通氣管,其前端自水平往下彎曲45°以上管口裝設細目銅網防止引火及雨水之浸入,室內儲存槽時通氣管直徑為30mm,自建築物窗口往外延伸1公尺以上。
(F)鋼裝桶等容器應避免日光之直射,遠離熱源。
(G)在實驗室所用瓶裝苯、甲苯、二甲苯等物應放置於遠離加熱器,如電爐、烘箱、本生燈、酒精燈等以避免引火。
(8)使用或製造上之注意
由接管大量輸送苯、甲苯、二甲苯時因在管內流通之溶劑能產生靜電,所以需有接地線,開啟鋼製容器時先確定周圍無明火,否則夏天桶內有內壓飽和溶劑之混合氣逸出時易引火。
(9)漏洩時之處理
破損鋼瓶為例以破損處向上移至安全場所,將內容物移至新容器。燒焊破損容器時需用蒸氣洗去桶內苯、甲苯或二甲苯後以檢知管測試確認無殘留痕跡後始能焊接。儲存槽時先水洗吸取上層之苯後排水再用蒸氣洗淨,放冷後測試槽內之殘留溶劑量,確認無引火危險後始可焊補。
(10)滅火
可用泡沫,乾粉或二氧化碳,大型火災時以泡沫為主,直立儲存槽時由入孔或輸料管注入泡沫或二氧化碳以遮斷空氣之接觸。滅火時切勿用水否則不但無法滅火。浮在水上之苯、甲苯、二甲苯溢出後火災面積會擴大,燃燒中之儲存槽自外殼用水冷卻時對滅火有幫助。
二、乙醚C2H5OC2H5 (Diethyl
ether)
乙醚在化學實驗室進行有機反應,萃取某種成分或在化學工廠大量當作溶劑以及合成原料使用。因沸點僅在35℃不但易氣化,且爆炸範圍寬,同時具有能自靜電引火,加氧化劑時會爆炸,對危險度而言屬於特殊引火性物。
(1)理化性質
名稱:化學名:乙醚,Ethyl ether或Diethyl ether,化學式:(C2H5)2O
m.w.=74.12
(A)物理性質:外觀:無色透明特異香液體,比重:d154=0.7192,d204=0.7143,蒸氣密度2.57 (空氣=1),沸點:34.6℃ (760mmHg),熔點:α (-116.3℃)、β (-123.3℃),臨界溫度:194℃,臨界壓力:35.61atm,引火點
-45℃,發火點180℃,爆炸界限:空氣中為1.91~36 vol%,氧氣中為2.0~82 vol%,燃燒熱:8800 cal/g,蒸發熱:89.8 cal (30℃),對水之溶解度(Wt);10℃ (9.0%),20℃ (6.9%),25℃ (6.2%),30℃ (5.5%),其他能溶於濃鹽酸,低級醇,苯,氯仿,石油醚等。
(B)化學性質
(a)在空氣中易受氧化,長期儲存,受日光照射時產生過氧化物,在實驗室蒸餾含有過氧化物之乙醚時勿蒸餾至乾涸否則容易爆炸。以遮光容器在15℃以下儲存時過氧化物則不易產生。儲存中倘加入乙醇2 %,水0.5 %於乙醚中或加穩定劑時可抑制過氧化物之產生。
(b)加氧化劑如硝酸時反應激烈而爆炸。
(c)乙醚蒸氣在空氣、銅等共存下加白金黑催化劑並加熱至100℃時會產生乙醛,以無水酪酸或硝酸氧化時可得醋酸。
(d)加入三氟化硼,溴化汞,四氯化鈦等作用時形成如BF3(C2H5)2O結晶性附加物。
(2)爆炸性及引火性
(A)乙醚易蒸發,氣體乙醚之比重約空氣之2.55倍,氣化後沈降在地面或凹處。
(B)氣態乙醚在空氣中之爆炸範圍為1.9~36 vol%,由小火源也能爆炸。
(C)發火點180℃,屬於發火點較低之系列。
(D)在空氣中由光線產生過氧化物,受加熱時過氧化物容易爆炸。
(E)乙醚由摩擦產生靜電,在輸管中流動時或在容器內攪拌時甚至過濾時產生之靜電也足夠點燃乙醚與空氣之混合物。
(3)對生物體之影響
毒性雖低,但吸入時易呈麻醉狀態。乙醚在體內不容易代謝,大部分以未變化之形態由肺部以呼氣排出,只有極少部分自尿、汗排出。高濃度之乙醚進入體內時迅速呈現睏意,麻痺。意識不明等病狀。藥效消失時通常有頭疼,食慾減退,嘔吐,發汗等現象,乙醚有輕微之刺激作用。直接與皮膚接觸時會有輕度之炎症,在工作場所常與乙醚蒸氣接觸時眼睛粘膜會發炎。依ACGIH(1978)之建議15分鐘下短時間曝露限度(TLV-STEL)為500ppm,1日8小時加重平均濃度(TLV-TWA)為400ppm。
(4)用途
工業用途:化學用溶劑,無煙火藥原料。
醫學用途:麻醉劑,臨床用,醫藥精製。
實驗室用途:化學分析,化學合成,塗料,香料,油脂,化妝品之溶劑。
(5)分析方法
依試藥級,工業級,藥局方級等各有不同試驗法,以JIS試藥級試驗法為例:
(A)比重:0.720以下,以JIS K 8004-1961-6比重測定法為之。
(B)沸點:34~35℃,JIS K 8004-1961-2在34~35℃蒸餾,燒瓶內不得有殘留物。
(C)水分:0.2%以下,取20g試樣,以JIS K 8004-1961-19
Karl Fischer水分測定法為之
(D)酒精含量:0.01%以下,取72g試樣於分液漏斗,加20c.c.水,振動2分鐘,分取水層暫時保留,第二次加10c.c.水,第三次加5c.c.水,如第一次同每次振搖2分鐘,取水層合併混合,取其中5c.c.加硝酸鉻溶液10c.c.,放置1小時後比色。另以乙醇標準溶液(99.5 vol%) 0.16g加水稀釋至1公升取4.5c.c.加0.5c.c.水再加10c.c.硝酸鉻溶液,1小時後之色度當作空白試驗。
(E)不揮發成分:應在0.001 %以下,取100g試樣,在水溶上蒸發後在110℃乾燥時殘留物應在1mg以下。
(F)游離酸:應在0.0015 %以下(CH3COOH),取10c.c.乙醇(80 vol%)於共栓瓶內,如1%酚酞0.5c.c.,以0.02N氫氧化鈉溶液滴定,其滴定量不超過0.2c.c.為準。
0.02N NaOH Soln 1ml = 0.012g
CH3COOH
(G)過氧化物:取10c.c.試樣於試管內,加新配製10 %碘化鉀溶液1 c.c.,於1分鐘內上下兩層不出現黃色為原則。
(H)醛及酮類:取20c.c.試樣於共栓瓶內,加含有Nessler試劑l c.c.,飽和氯化鈉溶液17 c.c.之混合液7 c.c.,振搖10秒鐘,於1分鐘內不能呈現混濁狀。
( I )酸著色物:取冷卻至10℃之硫酸10ml,攪拌下滴加10c.c.試樣時不能有顏色出現。
(6)容器
乙醚有低溫揮發性,特殊引火性,瓦斯爆炸性等高度危險性。對容器,包裝需特別注意
鋼製桶:最大容量220公升,小型者容量20公升。
玻璃瓶:1.1公升,上列容器之實裝量應在95%以下。經密封後外包裝以瓦楞紙箱,木箱為主,其空隙需用充填物塞緊,內外包裝表面需有乙醚,容量,嚴禁火氣,輕放,上下箭頭等字樣及標識。
(7)輸送上之注意
(A)瓶口、罐口、桶口需向上,裝載前需檢查有無破損或漏洩跡象。
(B)裝卸時應避免碰撞,裝運途中需覆蓋帆布勿受日光直晒。
(C)夏季溫度高,罐、瓶、桶內有壓力,開啟前宜用冷水冷卻外面以免乙醚逸出。
(D)運輸過程中需配備乾粉,海龍,二氧化碳等滅水器。
(8)儲存及使用上之注意
需遵照有關危險物品製造位置,構造,設備等基準,以及滅火設備及操作基準外需注意下列各項:
(A)乙醚氣易揮發,由封口鬆馳,桶蓋墊之老化等皆能成為引燃之原因。乙醚之瓦斯比空氣重2.5倍,所以容易沈積在地面,水溝等處。可能有漏洩時可用干擾式檢知器,接觸燃燒式,半導體瓦斯檢知器或用乙醚專用檢知管測出是否已進入爆炸範圍內。
(B)製造業及裝填場無法避免乙醚之蒸發,此場所應設置排出於屋外高處之抽氣設備。
(9)過氧化物之問題
(A)乙醚之純度愈高,而水分含量愈少時過氧化物之生成愈容易。
(B)儲存溫度愈高生成過氧化物之速度愈快,理想之溫度在15℃以下。
(C)避免日光之直晒,勿裝在無色容器內,應使用有顏色之玻璃瓶裝並置於冷暗處。
(D)容器中乙醚量由使用而減少,此時瓶內所佔空氣體積愈多過氧化物之生成則無法避免。
(E)儲存中加二羥苯等穩定劑,至於是否含有過氧化物可加10%碘化鉀溶液則可測試。使用前應先檢查是否含有過氧化物。
(10)靜電問題
對可燃性液體而言由靜電引起燃燒時只要有下列條件下則可引燃:(a)需有足夠引爆之瓦斯含量(b)已有靜電而蓄積充分之電荷(c)蓄積之電荷大於著火所需能量(d)能在爆炸範圍內放電。
因需具備上列條件之故對靜電則有適當之對策,如防止乙醚與空氣形成爆炸性混合氣,以接地或調整濕度防止靜電之產生,防止放電等措施實有必要。其次可燃性液體與固體摩擦時易產生靜電。在配管內之液體需保持一定流速之下,由管內液體流動產生之靜電與管中之線速度2乘成正比,世界各國通常以l m/s速度認為相當安全之數字。此數字大約等於直徑1英吋管以7分鐘充填200公升之液量。配管勿用聚乙烯,鐵氟龍等合成材質,應使用能導電材質同時也需接地。
(11)漏洩時之處理
應立即去除附近火源,塞緊漏洩處。漏出液體以破布等吸取後放入鐵罐中密封,確認無火源處使其揮發。容器部分則移至空曠處在安全場所重新改裝。
(12)滅火
乙醚用水不易滅火,初期之滅火可用乾粉,鹵化碳氫化合物,二氧化碳,泡沫等,用砂覆蓋時乙醚氣易滲出而效果不彰。兩種滅火劑之併用似可提高滅火效果。
三、二硫化碳CS2,(Carbon
disulfide)
二硫化碳用於黏液嫘縈(Viscose)合成,製造橡皮加硫促進劑,殺蟲劑及當作橡皮、硫磺、樹脂、磷等之溶劑。其用途甚廣且引火點、發火點低、易蒸發、爆炸下限低、燃燒範圍廣、火災危險度高,屬於特殊危險物品之一。在預防及消防之立場上應特別加以注意。
(1)理化性質
外觀:常溫下為無色透明液體,高純度者接近於無臭,通常有異臭為多。
比重:d204
1.2629 (水=1)
蒸氣密度:2.67 (0℃,1atm,空氣=1)
沸點:46.45℃ (760mmHg)
熔點:-111.5℃
引火點:-30℃
發火點:90℃
比熱:(-73.3~176.6℃) 0.23~0.24 cal/g.deg
燃燒熱:264.6 kcal/g.mol
爆炸界限:25℃(F.L. 1.25,50),100℃(1.03,50.2),200℃(0.73,50.5),400℃(0.13,51.5)
蒸發熱:84 cal/g (760mmHg)
折射率:1.62794 (20℃)
臨界壓力:72.9 atm
臨界溫度:280℃
溶解度:0.22g CS2/100ml H2O (22℃),0.0lwt% (25℃)能與醇、乙醚、苯及其他有機溶劑互溶。無吸濕性,由光線之影響顏色變黃。
(2)化學性質
(A)製造法:
通常用木炭或甲烷與硫磺之蒸氣在750~1000℃反應而得。
C+2S→CS2
其他也有使用天然氣或用石油為原料製成
CH4+4S→CS2+2H2S
(B)一般反應:
(a)易引火,火焰為青色焰,燃燒時有二氧化硫之刺激臭
CS2+2O2→CO2+2SO2
(b)高溫下受氫之還原,產物為硫化氫、碳、甲烷等,在還原鎳存在下可得二磺酸甲烷
CS2+2H2→2H2S+C
CS2+4H2→2H2S+CH4
|
180℃
Ni |
(c)常溫下不會與水反應,至150℃以上時分解產生二氧化碳及硫化氫
CS2+H2O→COS+H2S
CS2+2H2O→CO2+2H2S
(d)用鐵、氯化鋁、三氯化銻等為催化劑時二硫化碳能與氯氣作用而產生四氯化碳
CS2+3Cl2→CCl4+S2Cl2
(e)鹼性纖維素加二硫化碳混合時可得纖維素黃原酸納,此物溶解於稀氫氧化鈉之溶液稱為黏液嫘縈
|
|
(f)能與苯胺反應而得硫代二苯
CS2+2C6H5.NH2→SC(NHC6H5)2+H2S
(g)能與二甲基胺、氫氧化鈉反應生成二甲基磺氨基碳酸鹽
(CH3)2NH+CS2+NaOH→(NH3)2NC(S)SNa+H2O
(h)與氧化鎂加熱時產生氧硫化碳
CS2+MgO→COS+MgS
在110℃下加尿素時亦能產生氧硫化碳
NH2CONH2+CS2→COS+NH4SCN
(3)爆炸性及引火性
(A)二硫化碳容易揮發,且引火點 -30℃,發火點90℃易燃燒之液體,甚至接觸到燈泡表面或高溫之蒸氣管時有可能起燃。
(B)二硫化碳之蒸氣與空氣混合時形成1.25~50 % (vol%,25℃)之爆炸性混合氣,此等數字則屬於高度危險性。
(C)二硫化碳之爆炸危險溫度範圍為-30~20℃,所以儲存在密閉容器中時溫度雖在20℃以下之狀態有火源時仍會爆炸。
(D)屬於非導電性,因此流動狀態、過濾或由高處滴下時容易帶電,此時有火花則起爆炸。
(E)蒸氣比空氣重2.64倍,沿低窪處移動時遇有火源則起燃。
(4)腐蝕性
高純度之二硫化碳在常溫對工業用金屬材料無腐蝕作用,但儲存時間久又溫度較高時會產生硫化合物而引起腐蝕作用。二硫化碳能溶解橡皮、合成樹脂等物,有可能接觸之處所應使用特製合成橡皮或石棉。
(5)對生物體之影響
吸入二硫化碳蒸氣或長時間與液狀二硫化碳接觸時會出現神經系之障害。急性中毒時會有類似酒精、氯仿之麻醉作用,通常由興奮狀態再進入麻痺狀態而呈意識不明,嚴重時由呼吸麻痺致死。在數百ppm蒸氣下每日繼續工作時自數週至數個月內發生頭疼、神經過敏、各種自律神經障礙、消化系統受損等病態。在數十ppm下則有慢性中毒之可能,自覺性病狀為疲勞感、頭昏、健忘、不眠、神經炎、麻痺等。在空氣中含有500 ppm時數小時內呈頭昏,1000ppm時1小時內進入危險狀態,3000ppm以上時1小時內會致死。二硫化碳屬於脂溶性與皮膚接觸時溶去皮膚上之脂肪而使皮膚龜裂。
(6)分析法
(A)二乙胺法:
二乙胺(C2H5)2NH乙醇溶液加銅鹽之反應液進入含有二硫化碳之空氣時產生二乙基二硫氨基甲酸再轉變為銅鹽而呈為黃金色,其色度與含量有比例關係,所以可用光電比色計與標準液之色度比對。
(B)檢知管法:
使用二硫化碳專用檢知管,由變色長度及檢知管上之數字可知空氣中之二硫化碳含量。
(C)氣相層析法。
(7)容器
(A)二硫化碳係引火性液體,其容器輸送時安全性高者為條件,少量時可用玻璃瓶,量多則用鋼製。
(B)玻璃瓶裝時需有木箱外包裝,瓶間以緩衝物隔開。
(C)容器內外需標明"危險物","嚴禁火氣"等字。
(D)改裝於另一容器時表面需用水覆蓋。
(E)避免使用PE等瓶。
(8)輸送上之注意
(A)裝卸場所勿抽菸,附近需標明"禁菸",電氣類需有防爆裝置。
(B)裝卸時必需先關閉引擎,裝卸操作應在白天進行,晚上之操作需使用防爆燈。
(C)裝卸操作避免碰撞、重擊、摩擦等。
(D)充填時避免日光直晒,需用遮光性材料覆蓋。
(E)運輸車輛側面及後面懸掛"危險物","嚴禁火氣"的標註。
(9)儲存上之注意
(A)遠離火源,注意通風,需在陰涼處,宜儲存在不燃構造之建築物內。
(B)瓶、罐容器時二硫化碳之表面用水覆蓋,並檢查瓶蓋是否有漏。
(C)儲存之周圖不可裝電開關、馬達、易引火性質、電氣設備需用防爆者。
(D)儲存槽需有接地線、避雷針、自動撒水裝置等。
(10)使用及製造上之注意
(A)二硫化碳之蒸氣比空氣重2.64倍,所以易沈積在低窪處。
(B)本身屬於非導電性,當流動時會帶電,所以有接地之必要。
(C)周邊之電氣設備需要防爆式,有可能漏洩之處所需裝自動撒水頭。
(D)接頭、風向、配管需用耐二硫化碳材質。
(E)工作場所之建築物牆及地面應使用不燃性材質,出入口應設兩處。
(F)當作溶劑使用時裝置為密閉式設計以防蒸氣外洩,並設逆流防止裝置。
(11)滅火
(A)二硫化碳比重較水大,火災時可用水覆蓋則可。
(B)初期滅火可用水霧、乾粉、二氧化碳。使用乾粉或二氧化碳滅火時雖然已被滅火但發火點低由餘熱有可能再起燃。
(C)使用泡沫時二硫化碳之蒸氣能自泡沫間冒出而維持燃燒,所以效果不彰。
(D)應設置消防栓、消防幫浦、固定式撒水設備。
(E)起燃時會產生毒氣及刺激性亞硫酸氣、硫化氫、二硫化碳蒸氣,滅火時應攜帶防毒面具。
四、甲醇CH3OH (Methyl alcohol,Methanol)
(1)理化性質
名稱:甲醇 (化學名)俗名木精,英文名稱:Methanol,Methyl
alcohol;
一般名稱:Carbinol,Wood spirit,Wood alcohol。
化學式:CH3OH 分子量:32.04
(A)物理性質:
外觀:常溫下無色有異香之透明液體,比重:d204=0.7928,蒸氣密度1.11 (空氣=1.0),沸點:64.65℃ (760mmHg),熔點:-96℃,臨界溫度:240℃,臨界壓力:78.51atm,引火點11℃ (密閉式),發火點470℃ (空氣中),爆炸界限:6.27~365vo l%,蒸氣壓:60mmHg (12.1℃),燃燒熱:173.6 Kcal/mol (25℃),蒸發熱:8.43 Kcal/mol,溶解熱:-1.59
Kcal/mol (H2O 25mol,25℃)。
(B)化學性質:
具有一個OH基之一價醇,易與水、乙醇、乙醚及其他有機溶劑互溶。銀、白金、銅等金屬共存下在空氣中緩慢被氧化為醛,氧化強烈時先成為甲酸而後變為二氧化碳。古時候用樺、楓檻、山胡桃等木屑在斷絕空氣下乾餾而得,故另有木精之別名,現在則以一氧化碳之加氫反應為主要製造法。
|
300~400℃
200~300atm ZnO,CrO3 |
(2)爆炸性及引火性:
(A)引火點11℃,其蒸氣在空氣中形成6.0~36.5%爆炸性混合氣。
(B)儲存在桶、罐、瓶等密閉容器時在11~42℃下在容器內形成爆炸性混合氣。

圖29 甲醇之蒸氣壓與爆炸界限
(3)腐蝕性
常溫下對一般金屬無腐蝕性。對鉛及表面無氧化膜之鋁則有緩慢之腐蝕作用。
(4)對生物體之影響
(A)刺激眼睛、鼻及咽喉粘膜,常與甲醇接觸時出現乾裂性皮膚炎。
(B)吸入高濃度蒸氣時會引起急性中毒,在1000ppm下呈現酒醉狀,頭痛、視力減退,5000ppm時引起昏睡以至死亡。
(C)毒性:LD50(鼠經口)12~24 ml/Kg。
(D)甲醇能自呼吸,經口及皮膚進入體內。在生體內通常氧化作用緩慢而有蓄積性。其主要毒性來自於在體內分解為甲酸HCOOH及甲醛HCHO,前者係視神經毒,後者則屬中樞神經毒。長時間在200ppm下工作時將引起亞急性及慢性中毒,同時也有視神經障礙或多發性神經炎。視神經障礙有眼痛、中心視野缺損、失明等病症。中樞神經系病狀有頭痛、噁心、頭昏、意識不明等。甲醇中毒時常有酸血症,嚴重時引起腎臟及肝臟障礙。
(E)容許濃度
依ACGIH(1978)建議之標準為15分鐘以下之曝露限度(TLV-TWA) 250ppm,1天8小時勞動之加重平均濃度為200ppm。
(5)規格
(A)工業用甲醇規格(參考JIS K 1501-1969)
比重:d154=0.798以下
甲醇含量:99.3%以上
蒸餾分(vol %):在64.0~66.0℃餾分96%以上。
游離酸(N/100 NaOH
ml/50ml):2以下
蒸發殘渣(%):0.002以下
碘仿生成物:0.1以下
高錳酸鉀還原性物:在標準色以下
(B)試藥級甲醇規格(參考JIS K 8891-1979)
比重:d204=0.794以下
蒸餾分(64~65℃):95%以上
折射率n20D:1.327~1.330
水分(%):0.1以下
不揮發物(%):0.0005以下
酸(HCOOH):0.002 %以下
鹼(NH3):0.0003以下
酮及醛(CH3COCH3):0.003以下
乙醇:規定內
高錳酸鉀還原性物:0.0005 %以下
硫酸著色物:規定內
甲醇含量(vol.%):99.6 %
(6)分析試驗
(A)吸光光度分析法
空氣中之甲醇以吸氣法用精製蒸餾水收集,經高錳酸鉀氧化所生成之甲醛與變色酸(Chromotropic
acid)反應時產生紅紫色以光度比色計測其吸收。試樣為液體時取10ml用蒸餾水稀釋為100ml,取其1ml及甲醇1ml各別置於試管中,加5 %磷酸溶液0.1ml及5 %高錳酸鉀溶液0.2ml振搖後放置15分鐘,再加20%亞硫酸鈉溶液0.3ml脫色,以冷水或冰水冷卻後加75v/v %硫酸4ml輕搖混和,其次加2%變色酸溶液0.3ml振搖,在80~85℃水浴中加溫10分鐘,冷卻後產生之呈色液以580nm測定吸光度,並由標準甲醇檢量線計算試樣溶液中之甲醇含量。
(B)檢知管法
檢知管有北川等產品,歐美產品亦可使用,測定範圍0.002~4.5 %/100ml氣體,呈色管中試藥顏色由淡桃紅色變為淡青色,自檢知管上之刻度直接獲知單位氣體容積中之甲醇含量。此方法之優點為攜帶方便,操作簡單,短時間內 (1~2分鐘)可得測定結果。惟其他溶劑共存時會受影響。
(C)氣相層析法
採氣時可用500或1000ml採氣筒在現場採氣攜帶分析,或抽取一定量氣體通過吸附劑,經加熱使吸附劑釋出甲醇後取樣分析。此方法有其他溶劑共存時方可獲得單一甲酵波峰而自標準甲醇波蜂面積計算試樣中之甲醇含量。
(7)容器
甲醇係引火性且有毒性之液體,對所用容器理應有正確之選擇。
小型容器:玻璃瓶、聚乙烯瓶、鐵皮罐、鋼製筒等較為合適。
玻璃瓶、聚乙烯瓶通常容量為1.1L,聚乙烯桶為10L,鐵皮桶為20L,鋼製桶則為220L。容器或包裝表面需顯示"甲醇"、"數量"、"嚴禁火氣"、"劇毒物"等字,瓶蓋、桶蓋墊圈需用甲醇不溶性之材質。
(8)輸送時之注意事項:
裝卸作業處需嚴禁火氣,並配置滅火器,電氣設備應有防爆措施。容器之裝載需防止顛倒、搖晃。以車輛運輸時避免日晒需有遮蓬,勿同時載送其他危險物品。
(9)儲存上之注意
(A)小型容器應儲存於屋內,儲存量多宜採用不燃結構或耐燃結構之建築物。
(B)儲存場所不得使用火源,同時需有充分之換氣設備。
(C)儲存容器需要固定,勿與能產生混合發火之物質共存。
(D)大型槽時儲存內容量勿超過90%,並定期檢查開關配管等有無漏洩。
(10)使用及製造上之注意
(A)使用場所禁用明火,有必要加熱時須用蒸氣等間接加熱,此時操作需在密閉或具有環流設備中進行,蒸氣之漏洩易引起作業人員之中毒。
(B)配管、製造設備需有接地措施。
(C)指定專業人員管理儲存、化驗、滅火、中毒時之急救等工作。
(11)漏洩時之處理
(A)小型容器時將破損處向上,移至空曠之安全場所,改裝於新容器。
(B)被污染之地點、物體可用水沖洗。
(C)貨卡車等載運量較多而發生漏洩時儘速將車輛移至無火氣之場所,關閉引擎及一切電路。
(D)大量漏洩時需設置臨時警戒線,標明何種物質正在漏洩。
(E)無法應急止漏,流出量逐漸擴散時應請消防單位支援。
(12)滅火
(A)甲醇係引火性液體,起燃後火災面積易擴大,所以初期滅火極為重要。初期滅火可用乾粉、二氧化碳、海龍系滅火劑。
(B)200L以上之火災可使用抗消泡性泡沫,一般泡沫之滅火效果不彰。
(C)甲醇之化學式僅有一個碳,燃燒時火焰接近無色,因此需正確判斷主要燃燒點之處所而加以進行滅火。
(13)急救
(A)由吸入而中毒時立刻移至空氣流通處,救護車未到達前給予保暖措施,呼吸停止時需進行人工呼吸。
(B)誤飲甲醇20~30c.c.時恐有失明之可能,70~80c.c.時會致死。此時先飲如高梁酒、白蘭迪等烈酒50~100c.c.,使胃中開始吸收酒精而使吸收甲醇之速度趨緩,以便儘速送醫。
(C)衣服沾有大量甲醇時儘早脫去,以流水洗淨皮膚以減少吸收甲醇。
五、乙醇C2H5OH,(Ethyl alcohol, Ethanol)
乙醇俗名酒精,酒中之主要成分。工業上亦可當作合成原料、溶劑、殺菌、燃燒等用途甚廣。以消防之觀點而言乙醇為沸點低,易燃性危險物品。依刑事化學之立場視為神經毒或揮發性毒物,如酒精中毒引起之死亡案件、飲酒駕車肇事等。
(1)理化性質
名稱:化學名-乙醇,Ethanol, Ethyl
alcohol, Methyl carbinol. 俗名-酒精,Spirit of wine.
化學式:C2H5OH 分子量:46.07
(A)物理性質
外觀:無色透明液體,有異香,比重0.7893(d204),蒸氣密度1.58 (空氣=1),沸點78.325℃(760mmHg),熔點-114.5℃,臨界溫度243.1℃,臨界壓力62.96 atm,引火點12.8℃,發火點392℃,爆炸界限:下限3.3,上限19 vol%,蒸氣壓14mmHg (19℃),燃燒熱:326.6 Kcal/mol,蒸發熱:10.337 Kcal/mol
(20℃),9.304 Kcal/mol (b.p.),溶解熱-2.67 Kcal/mol。
(B)化學性質
乙醇具有-OH基之飽和一價醇。易與水,其他醇類,乙醚等有機溶劑互溶。另有溶解多種金屬鹽類、鹼類、碳氫化合物、脂肪酸及有機化合物之功能。加氧化劑時產生乙醛,與酸類或其他無水物縮合成為酯。
(a)醇與氧化劑之反應:
![]()
(b)醇與無水物之反應:
(2)來源
工業上常用兩種方法,其一為澱粉經糖化或糖蜜為原料用酒精酵母發酵後蒸餾而得:
|
Yeast
|
另一為合成法,以乙烯為原料,用酸催化水解而得
|
Acid
|
(3)爆炸性及引火性
乙醇之引火點為12.8℃,在常溫下易引火。蒸氣與空氣混合時在3.3~19 %範圍內形成爆炸性混合瓦斯(圖30及圖31)。
乙醇儲存在密閉狀態之槽、桶、瓶中時只要溫度在12.8~42℃容器內已形成爆炸性混合瓦斯,此時倘有火源則起爆燃。乙醇之發火點在392℃,較碳氫化合物之發火點為低。
註:應避免加入之化合物如下:(如激烈反應、起燃或爆炸)。
(A)加醋酸及五氟溴(BrF5)。
(B)氨水及氧化銀(Ag2O)。
(C)次氯酸鈣[Ca(OCl)2]
(D)三氧化氯(ClO3)
(E)無水鉻酸(CrO3)
(F)過氧化氫(H2O2)
(G)硝酸汞[Hg(NO3)2]
(H)硝酸(HNO3)
( I )過氯酸(HClO4)
( J )硝酸銀(AgNO3)
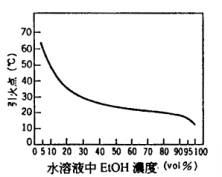

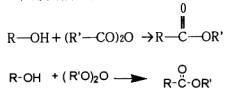
圖30水溶液中EtOH濃度(vol)與引火點之關係 圖31乙醇蒸氣壓與爆炸界限之關係
(4)腐蝕性
在室溫及常壓下對一般金屬無腐蝕性,但對鋁及鉛則有影響。乙醇經口、經皮及吸入均能進入體內。飲酒時自舌頭、口腔、胃、小腸急速被吸收,吸收速度依濃度而異。乙醇被吸收後由循環系傳達至體內之各組織。正常人其80~90%在生體組織中燃燒,其他2~4%由尿排出,5~10%經呼氣排出於體外。被吸收之乙醇主要在肝臟以ADH及輔酵素NDA氧化為乙醛最後轉變為水及二氧化碳。血液中之酒精濃度對人體之生理機能約有如下關係:血液中乙醇含量在50mg以下時對一般機能殆無影響,100mg%時臉部呈紅潤,並話多,200~250mg%時無法步行,思考力減退,300mg%時意識不明,400mg%時呈昏睡狀態,500~800mg%時屬危險狀態。
(5)分析法
(A)液態乙醇
(a)Lieber's反應:取1~5c.c.乙醇於三角燒瓶中,加氫氧化鉀溶液使成鹼性,加碘液至液體成為黃棕色,經放置或低溫下可得碘仿之結晶,此反應能與甲醇區別,但對丙酮、乙醛則有陽性反應,此時再進行(b)之試驗。
本反應之過程如下式:
I2+2KOH→KI+KIO+H2O
CH3CH2OH+KIO→CH3CHO+3KOH
CH3CHO+3KIO→CI3CHO+3KOH
CH3CHO+KOH→CHI3+HCOOK
(b)Berthelot反應
試樣溶液加氯化苯甲酸數滴,再加1 %氫氧化鈉溶液至臭味消失為止,有乙醇存在時產生安息香酸乙酸乙酯之香氣,丙酮則無此反應。
C6H5COCl+C2H5OH+NaOH→C6H5COOC2H5+NaOH+H2O
(B)氣態或呼氣中乙醇測定
空氣中之乙醇可用大型採氣筒(supersyringe)攜回儀器分析或當場使用檢知管法定量,呼氣中之乙醇由被測人吹氣在氣球內,用乙醇測定專用檢知管以抽氣筒取一定量呼氣,呼氣2公升中之乙醇含量則相當於1c.c.血液中之乙醇含量。此法簡便,準確度尚符合實務上之要求,所以各國常用於酒醉駕駛取締之依據。
檢知管內徑約3mm,長約15cm,內充填55~65mm含硫酸鉻試劑之矽酸膠,與乙醇接觸時呈顯綠色,其變色長度則表示單位體積氣體中所含乙醇濃度,可自檢知管上之刻度直接讀出。
註:液態氣乙醇均可使用氣相層析儀定量,分離管以PEG系較為合適,溫度70℃以FID檢測為宜。現場攜帶用檢測儀器有易燃瓦斯檢知器、干擾式檢知器等。
(6)輸送中之注意
(A)純度60 %以上者屬於第四類危險物品,依消防法令中管理辦法處理。
(B)乙醇之蒸氣容易引燃,在實驗室蒸餾過程中偶而有起燃之案例,酒精燈之使用也需要注意。
(C)乙醇蒸氣密度為1.58,自桶、槽流出之乙醇蒸氣易滯留於低窪處,倉庫內之通風應受重視。
(D)運輸時容器需密封,勿產生蒸氣溢出與火源接觸。
(E)大量乙醇之裝卸需事先檢查周圍之火源、配線、電器設備等問題,作業中車輛引擎需熄火,並懸掛危險物品、嚴禁火氣等標誌。
(7)滅火
少量乙醇在燃燒時可用水霧,數十公升以上之火災用水滅火時恐有火災面積擴大之可能,此時能使用抗消泡性泡沫(Alco-form)或乾粉為宜,小型火災時二氧化碳、海龍等均有效。
六、氨及液態氨NH3,NH4OH,(Ammonia and Ammonium hydroxide)
工業國家使用大量氨為製造硝酸、爆炸物,合成纖維,肥料等原料,其他如大型冷凍設備之冷媒、清潔劑、染料、氨鹽等用途甚廣。氨屬於毒物之一,過去數年內有數次發生氨氣外洩之案件,漏洩及滅火時應注意對人體之危險性。
(1)理化性質
名稱:氨氣 (Ammonia,Ammonia gas) NH3,m.w.17.03,氨水 (Ammonia water,Aqua ammonia, Ammonium
hydroxide) NH4OH,m.w. 35
(A)物理性質
氨氣:強刺激臭氣體,比重:0.5967(空氣=1),0.7714g/L。
對水之溶解度:0℃:47%,15℃:38%,20℃:34%,25℃:31%,30℃:28%。
液態氨:d204:0.9339 (1%),0.9811 (4%),0.9651 (8%),0.9362 (16%),0.9229 (20%),0.9101 (24%),0.8980 (28%)。95%乙醇在20℃下可溶於15%氨,甲醇在25℃時能溶於16%氨。氨水可溶硝酸鹽、碘化物、酚類及胺類化合物。
氨氣之爆炸上限為28%,下限15%,發火點651℃。
(B)化學性質
(a)氨氣在氧氣中燃燒時產生黃色火焰、分解為氮及水。
4NH3+3O2→2N2+6H2O
(b)能與多種金屬作用,加鈉金屬時得鈉氨鹽。
2NH3+2Na→2NH2Na+H2
(c)與鹵素作用時釋出氮。
2NH3+3Cl2→6HCl+N2
HCl+NH3→NH4Cl (白煙)
Cl2過剩時形成黃色爆炸性三氯化氮
NH4Cl+3Cl2→NCl3+4HC1
(d)加酸時形成氨鹽,對多種化合物依配位結合生成氨醋鹽。
AgCl+3NH3→AgCl.3NH3
Cu2++6NH3→[Cu(NH3)6]2+
(e)液態氨在電離時有下列平衡關係:
2NH3→(H.NH3)++(NH2)-
→(NH4)++(NH2)-
(f) lN液態氨pH=11.6,溫度上升時釋出氨氣。
(2)爆炸性及引火性
(A)液態氨在常溫常壓下易放出氨氣,加溫時釋出速度加快。氨氣雖然屬於不易燃之氣體,但有明火而連續供應氨氣時會燃燒。
(B)氨氣與空氣之混合物其上下限各為28及15%,有火源時易爆炸。無火源而在密閉容器中被加熱時易破壞容器形成氣爆。
(C)液態氨與鹵素,強酸接觸時起激烈反應,有爆炸、飛濺等潛在危險性。
(D)應避免加入下列物質:
乙醛、丙烯醛、溴、碘、氯、氟、氯酸鹽、鉻酸鹽、肼、鹼金屬、硝酸、二氧化氮、五氧化磷、苦味酸、氯化鉀、銀、氯化銀、汞、硫等。
註:液態氨加入上列物質時危險性較氣態氨為低,但被加熱釋出為氨氣時其危險性則相同。
(3)腐蝕性
對銅、銅合金、鋁及鋁合金有強腐蝕性。接觸面或容器可用鐵、鐵合金、玻璃、橡皮、聚乙烯等材質。
(4)對生物體之影響
依Lahmann之動物實驗顯示,氨對粘膜尤其對眼睛結膜及角膜有強刺激性。吸入初期上氣道受刺激之故呼吸、心臟等機能轉弱。次之,血壓上升,呼吸急速,高濃度時形成肺水腫。對人體而言吸入140ppm (0.1mg/L)時有輕度刺激性,350ppm (0.25mg/L)下有不快感,體能尚可維持1小時。以200~300ppm (0.15~0.25mg/L)下進入體內之氨約有12.5由肺部排出,繼續吸入30分鐘時出現流涎、嘔吐、頭痛、流汗、充血、胸痛、頻尿等病狀。濃度增高後經過數日尚有發現肺水腫之病例。在250ppm (1.75mg/L)時有立刻致死之可能。慢性中毒時呈現消化機能障礙、結膜炎、支氣管炎等。容許濃度ACGIH(1976)建議15分鐘以下短時間曝露限度(TLV-STEL)為35ppm,1日8小時勞動之加重平均濃度(TLV-TWA)為25ppm。
(5)分析試驗
液體氨之純度試驗
(A)定性試驗:有刺激性臭味、強鹼性、與少量鹽酸接觸產生氯化銨白煙,加硫酸銅溶液時呈淡青色。
(B)定量法:
(a)Lange-Hearty法:經過乾燥之Lange-Herty滴管取50ml液態氨,於常溫使氧化,約3小時後殘留物將沈降至細管之下方,紀錄其容量由下式計算氨之 %。
|
A = |
100- |
S-s×a |
×100 |
|
M+S |
A:氨% S:殘留物 (g)=殘留物容量(ml)×0.9
a:比重0.9氨水1g中之NH3重量(g)=0.283
M:試樣中純氨重量(g)=[50-殘留物(ml)]X0.68
註:15℃氨水比重為0.9,沸點(-33.4℃)時之比重為0.68。
(b) JIS K 8508-1971法:共栓瓶秤取15ml水.再加約2g氨水後正確秤量之。加入1N硫酸50ml,以甲基紅及甲基藍混合試劑為指示劑用1N氫氧化鈉溶液滴定。
1N H2SO4
lml=0.017032g NH3
(c)檢知管法:適合空氣中或混合瓦斯中氨氣之定量。由抽氣筒經連接氨氣定量專用之管上之刻度獲知其含量。高濃度氨之測定可用矽酸膠吸附鈷鹽之檢知管,低濃度之測定則用合成樹脂吸附指示劑之檢知管(如Gas Tech. Cat No. 3H)。
(6)容器
磅裝者常用玻璃瓶,量多則用鋼製容器,有50Kg、100Kg、1000Kg。卡車載運時常有4t、8t、10t、20t。液態氨需受高壓瓦斯,劇毒物及勞動安全衛生法之管制,所裝容器有無縫鋼製及燒焊容器2種,均需經過高壓瓦斯有關檢查項目。在國外工業國家對容器檢查合格者附有檢查合格證明書。液態氨鋼瓶上都有如下圖之刻印並漆上面積約1/10之白漆,容器上加貼毒物、可燃物等標籤。容器及安全閥需定期檢查。
□內容物明稱 v:內容積(L) W:容器質量(kg) 8:耐壓試撿合格年月 TP:耐壓試檢壓力
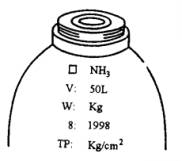
圖32氨鋼瓶上之刻印及表示事項
安全閥需具備在耐壓試驗80%以下能起動之彈簧式或30Kg/cm2,75C下能起動之可熔栓始可。充填量過多時由膨脹產生內壓,為防止容器之破損,充填前可用下式計算:
G=V / 0.86
G:液化瓦斯質量(Kg)
V:容器之內容積(L)
充填50公升容量時空間率在35℃時約為8.4%。
(7)輸送上之注意
輸送中避免碰撞、顛倒、漏洩、破損、日晒等情形發生。輸送、存放處所溫度需在40℃以下。以車輛載運時容器需加以固定,勿同時裝載其他危險物品。
(8)存放及使用上之注意
在實驗室氨水通常為玻璃瓶磅裝,應避免存放在東西方向之實驗桌及接近加熱器之場所,尤其夏季隨著氣溫上升有時由內壓容器破裂或瓶蓋之腐蝕而漏洩。常使用氨時需帶防護眼鏡及需裝設沖洗設備及急救箱。
(9)漏洩時之處理
液態氨漏洩時產生氨氣,因比空氣輕,易擴散。此時儘早去除熱源。大量漏洩時可用水霧消除,惟氨易溶解在流水中成為強鹼性,對魚類及農作物之影響應加注意。
(10)減火
氨雖然不易燃,但屬於可燃性,起燃時以水霧為主要滅火劑,小型火災時各種滅火劑均可適用,但氨本身不能去除。
七、氯仿、四氯化碳CHCl3, CCl4,(Chloroform, Carbon tetrachloride)
兩者均屬不燃性,但受熱時易產生有毒氣體,工業上大量使用於冷媒之製造,溶劑,合成原料等,四氯化碳會被使用為滅火劑,因毒性強,污染環境等原因現在已不常用。
(1)理化性質
名稱:
化學名:氯仿 (Chloroform,Trichloromethane)
化學式:CHCl3 分子量:119.38
化學名:四氯化碳 (Carbon
tetrachloride,Tetrachloromethane)
化學式:CCl4 分子量:153.84
表25氯仿,四氯化碳之物理性
|
(A)物理性質 |
氯 仿 |
四氯化碳 |
|
外觀 |
無色透明,易揮發性液體 |
常溫下無色透明 |
|
香臭味 |
無刺激性特異臭 |
特異臭 |
|
比重d204 |
1.489 |
1.595 |
|
蒸氣密度(空氣=1) |
4.12 |
5.32 |
|
沸點(℃)760mmHg |
61.2 |
76.8 |
|
臨界溫度(℃) |
263 |
283.2 |
|
臨界壓力(atm) |
53.8 |
45 |
|
折射率n15D |
1.448 |
1.4604 |
|
比熱(cal/g℃,20℃) |
0.234 |
0.207 |
|
粘度(cp,20℃) |
0.564 |
0.969 |
|
溶解度(g/100g H2O,20℃) |
0.822 |
0.08 |
|
蒸發熱(cal/g) |
59.0 |
46.5 |
|
吸濕性 |
有 |
無 |
|
體膨脹率 |
0.001399 |
0.00124 |
|
蒸氣壓(mmHg) |
|
|
|
溫度(℃) 0 |
61.0 |
33 |
|
10 |
100.5 |
56 |
|
20 |
159.6 |
91 |
|
30 |
246.0 |
143 |
|
40 |
366.4 |
216 |
|
50 |
526.4 |
317 |
(B)化學性質
(a)氯仿
A)工業上可自甲烷導入氯而得,合成副產物有氯甲烷,鹽酸等。
CH4+3Cl2→CHCl3+3HCl
CH3Cl+2Cl2→CHCl3+2HCl
CH2Cl2+Cl2→CHCl3+HCl
B)常溫下受空氣或光之分解而產生光氣,氯化氫,二氧化碳等。
CHCl3+1/2 O2→COCl2+HCl
COCl2+H2O→CO2+2HCl
C)溫度超過45℃時起熱分解,產物有四氯乙烯,氯化氫。
D)有鐵及水分共存時產生過氧化氫。
CHCl3+O2→Cl3COOH(+H2O)
→Cl3COH+H2O2
Cl3COH→COCl2+HCl
E)有Cl2存在時產生四氯化碳及鹽酸
CHCl3+Cl2→CCl4+HCl
F)加氫氧化鉀在高溫下反應時會生成甲酸鉀及氯化鉀。
CHCl3+4KOH→HCOOK+3KCl=2H2O
G)加鹼金屬氫氧化物雖在50℃下亦能與丙酮縮合形成氯丁醇
![]()
H)加苯胺後在鹼性醇溶液中反應時可得苯異睛
CHCl3+C6H5NH2+3KOH→C6H5N=CO+3KCl+3H2O
I )加鉻酸氧化時產生光氣及氯氣,當加水在225℃長時間加熱時生成一氧化碳及鹽酸。
J )與火焰或與熱氣接觸時易分解為一氧化碳,二氧化碳,鹽酸,光氣及氯氣。
(b)四氯化碳
A)工業上以一個碳之碳氫化合物如甲烷或用二硫化碳進行氯化反應,另以丙烷加熱氯化亦可。
4CH4+10Cl2→CCl4+CHCl3+CH2Cl2+CH3Cl+10HCl
CS2+2Cl2→CCl4+2S
3CH3OH+6Cl2→CCl4+CHCl3+CH2Cl2+3HCl+3H2O
C3H8+8Cl2→CCl4+C2Cl4+8HCl
B)四氯化碳在常溫乾燥狀態下相當穩定,當有水分存在時開始緩慢分解,產生之產物有光氣,氯化氫。接觸到灼熱金屬或對金屬火災以滅火劑使用時此反應更容易 發生。
2CCl4+O2→2COCl2+2Cl2
CC14+H2O→COCl2+2HCl
3CCl4+Fe2O3→3COCl2+2FeCl3
C)有鐵屑,水等共存時形成氯仿,加鋅及鹽酸時先生成氯仿再變成甲烷,被還原時生成氯仿,氯烯,甲烷等。
CCl4+2H→CHCl3+HCl
CCl4+8H→CH4+4HCl
D)加含有氫氧化鉀之乙醇溶液後加熱時起分解產生碳酸鉀及氯化鉀。
2CCl4+6KOH→K2CO3+4KCl+3H2O
E)加發煙硫酸時生成光氣等物。
2CCl4+H2SO4+SO3→2COCl2+S2O5Cl2+2HCl
(2)爆炸性及引火性
(A)氯仿
(a)常溫下屬於非燃性,但在氧氣中似有燃燒之可能。
(b)有水分經過長時間水解時會產生鹽酸,與金屬接觸時產生氫氣。於金屬容器內在適當條件下有可能氣爆。
(c)氯仿加氫氧化鉀後再加甲醇時會有激烈之反應。
(B)四氯化碳
(a)能用於滅火,無燃燒性。
(b)對鹵元素有高活性之金屬加入四氯化碳時可能會爆炸,此等金屬有鈉、鉀、鈣、鎂、鋇等。
(3)腐蝕性
(A)含穩定劑之氯仿及四氯代碳在常溫及無水分之條件下殆無腐蝕性。不含穩定劑或受空氣、光線、水分等影響會引起分解產生鹽酸以致腐蝕金屬材料。
(B)對合成橡膠、合成樹脂均有不同程度之溶解性,所以不宜接觸,容器可用玻璃製為宜。
(4)對生物體之影響
(A)氯仿、四氯化碳之容許濃度於1978年ACGIH數字為一天8小時勞動加重平均濃度(TLV-TWA)各為10ppm,15分鐘以下之曝露濃度(TLV-STEL)對四氯化碳訂為20ppm,日本產業衛生學會則建議各為50及10ppm。
(B)吸入蒸氣或皮膚,粘膜接觸後會出現肝、腎、心、肺等內臟及消化、神經等系統障礙。
(C)經皮膚吸收時會出現局部皮膚炎,因皮膚脂肪被溶去所以皮膚呈現粗糙而有灼熱感
(D)誤飲氯仿時口腔、食道、胃等組織有灼熱感,臉部呈紅潤,噁心、嘔吐、意識不明、肺炎、肝臟、腎臟障礙等病狀出現。
(E)吸入大量蒸氣時易出現急性中毒,低濃度但長時間之吸入也能引起頭昏,思考錯亂,食慾不振。不眠等病狀。
(5)用途
氯仿與四氯化碳之用途為製造冷煤、氟樹脂、滅火劑等之原料,其他大量使用於多種物質之溶劑。
(6)分析法
在設備完善之環境下可用儀器分析,對消防人員而言,適合於現場有檢知管法等簡便法
(A)檢知管法
在現場以常法使用連接氯仿與四氯化碳專用之檢知管,由抽氣筒抽取一定量氣體使通過檢知管內之試劑,由刻度上顯示之變色前端位置可知單位體積內之含量。
註:氯仿檢知管所裝試劑為O-Toluidine,呈色由灰白變為橙色,四氯化碳之試劑為Dimethyl aniline+Dimethyl aminobenzaldehyde,呈色由黃色變為青色。但檢知管法需注意共存物存在時帶來之干擾問題。
(B)儀器分析法
需精密分析時可用紅外線光譜分析與標準檔案比對,坊間資料甚多。
(7)輸送上之注意
(A)裝運前任何大小容器事前需檢查有無漏痕,大型容器時對開關,接頭尤須注意。
(B)比重比其他溶劑大,為防止碰撞時易造成破損,運輸時容器需加以固定。
(C)該兩種溶劑對水不互溶,漏洩嚴重時先接於裝水之容器內防止由液面之蒸發,再用虹吸原理將下層之溶劑移入新容器內。
(D)易蒸發而蒸氣屬於劇毒物。在空氣流通不良,或低窪處操作時需帶空氣瓶。
(8)儲存時之注意
(A)四氯化碳可裝在鍍鋅或鍍錫鐵質容器中,但電鍍層剝落時則開始腐蝕容器。氯仿通常有加入穩定劑,可用金屬容器儲存,未加穩定劑者宜用褐色玻璃瓶。
(B)合成樹脂系容器易起溶解或膨脹故不宜使用,在實驗室可能接觸之器材應避免使用合成樹脂,人造或天然橡皮等物。
(C)產生之蒸氣比空氣重,因沈降在低窪處不易擴散,儲存場所應避免空氣流通不良之處。
(D)儲存在陰涼通風良好,且勿有日光直晒,儲存場所需有劇毒物等標誌。
八、苯胺,硝基苯Ph-NH2,Ph-NO2,(Anilline,
Nitrobenzene)
苯胺及硝基苯在實驗室係常使用試藥之一。工業上大量用於合成各種樹脂,醫藥外當作溶劑用因屬於易燃及有毒之物,使用時應特別小心。
(1)理化性質
名稱:苯胺: Aniline, Phenylamine,
Amino benzene
化學式:C6H5NH2:93.12
名稱:硝基苯: Nitrobenzene,
Nitrobenzol
化學式:C6H5NO2:123.1
(A)物理性質
表27 苯胺與硝基苯之物理性質
|
|
胺苯 |
硝基苯 |
|
外視 比重d20 蒸氣密度(空氣=1) 沸點(℃) 引火點(℃) 發火點(℃) 爆炸下限 溶解度 |
無色或淡黃色液體 有胺臭 1,022 3.22 184.2 76(密閉式) 770 1.3 對乙醇、乙醚、苯等能互溶。在20℃下對水能溶3.5% |
淡黃色液體有特異香
1.204 4.25 210.9 87.8 482 1.8 可溶於大多數之有機 溶劑。在20℃下對水能溶0.19% |
(B)化學性質
(a)苯胺易受氧化而在空氣中逐漸變為褐色。加濃硫酸或濃硝酸時起激烈反應而起燃。加氯酸鹽或重鉻酸鹽之酸性溶液後進行氧化時可得穩定之黑色物,此物用於染料或木質實驗桌桌面之塗料。
A)苯胺屬於弱鹼性,加鹽酸時形成鹽而可溶於水
C6H5NH2+HCl(aq)→C6H5NH2.HCl
B)苯胺之酸性水溶液在低溫下加亞硝酸時形成疊氮物,此反應用於染料之合成。
C6H5NH2+HCl+HNO2→C6H5N2Cl+2H2O
C)苯胺加溴水時立即形成不溶性三溴衍生物
D)加有機酸或氯化乙醯在加熱下生成N-酸衍生物。
C6H5NH2+CH3COOH→C6H5NHCOCH3+H2O
(b)硝基苯有氧化性,在實驗室常用作有機合成之氧化劑。
A)合成鹼性色素如品紅染料時可用苯胺、O-、P-茄胺混合物加硝基苯後加熱。
B)工業上用鐵粉及鹽酸與硝基苯製造苯胺。
C6H5NO2+6H→C6H5NH2+2H2O
C)加鋅粉(或鐵粉),氫氧化鉀時產物為氫化偶氮苯。
![]()
![]() 2C6H5NO2→C6H5N-NC6H5→C6H5N = NC6H5→C6H5NH-NH C6H5
2C6H5NO2→C6H5N-NC6H5→C6H5N = NC6H5→C6H5NH-NH C6H5
O
D)濃氯化銨水溶液加硝基苯並緩慢加鋅時可得苯胲。
C6H5NO2+2Zn+3H2O→C6H5.NHOH+2Zn(OH)2
(2)爆炸性及引火性
(A)兩者均屬於常溫下能揮發之可燃性液體。
(B)苯胺之引火點為76℃,硝基苯為87.8℃,下限各為1.3及1.8%。
(C)苯胺在15℃時比重為1.026,溫度上升接近於水沸點時苯胺會浮出水面,此時則可引火。
(D)苯胺與濃硝酸混合時反應激烈而有起燃之可能。
(3)對人體之影響
苯胺及硝基苯可溶於有機溶劑,因此易自皮膚吸收,當吸入蒸氣時迅速溶於血液中而引起中毒。誤飲10g苯胺時則屬嚴重之中毒,對溫血動物之致死量為0.5g/Kg。硝基苯之致死量在4~10g。硝基苯之容許濃度ACGIH(1978)在15分鐘以下短時間曝露限度(TLV-STEL)為2ppm,一天八小時勞動加重平均濃度(TLV-TWA)為lppm。
(4)檢測法
欲檢測空氣中之苯胺含量時以瓦斯採氣筒(或瓶)取樣,用Gastech No.181苯胺專用檢知管(2.5~30ppm)較為方便(北川製,德國製均可)。液態時以紅外線光譜儀分析,必要時使用氣相-質譜儀證明。
(5)輸送時之注意
(A)搬運時勿同時裝載其他危險物品,惟少量時尚可斟酌。
(B)搬運中容器需固定,並應有危險物品之標誌。
(C)需用帆布等覆蓋,避免直接日晒。
(D)裝卸時周圍不該有熱源或火源。
(6)使用上之注意
(A)大量使用時需用橡皮手套、橡皮鞋等。
(B)勿在通風不良處大量使用,注意風向以免吸入蒸氣。
(C)腎臟、肝臟機能差,過敏性體質者不宜接觸。
(7)漏洩時之注意
(A)小型容器時將破裂處向上,搬至通風良好處,站在上風處裝入新容器。
(B)漏洩在地上之部分用乾砂或木屑吸附後攜至焚化爐處理。
(C)漏洩量多則用水蒸氣或大量水徹底沖洗。
(D)破損容器內之殘留物加鹽酸或醋酸使成為易溶於水之鹽類以便洗滌。
(8)滅火
(A)初期滅火可用二氧化碳、乾粉或泡沫。
(B)大量儲存場所則用泡沫及水霧。
(C)被加熱時有毒氣產生,易自呼吸及皮膚吸收,所以應帶防毒面具、橡皮手套及能覆蓋皮膚之消防衣。